
삼성바이오에피스가 미국 식품의약국(FDA)으로부터 안과질환 치료제 '오퓨비즈(성분명 애플리버셉트, 아일리아 바이오시밀러)'의 허가를 받았으나 웃지 못하고 있다. 오리지널 개발사와 특허분쟁으로 실제 출시까지 긴 시간이 걸릴 것으로 예측되기 때문이다.
FDA는 지난 20일(현지시간) 삼성바이오에피스의 아일리아 바이오시밀러 오퓨비즈와 인도계 제약사 바이오콘이 개발한 '예사필리'의 품목허가를 승인했다. FDA가 허가를 내준 아일리아 바이오시밀러는 이번이 처음이다.
미국계 제약사인 리네제론이 바이엘과 공동 개발한 황반변성 치료제 아일리아는 지난해 글로벌 매출액 93억8000만달러(12조8300억원)를 기록했으며, 이 중 미국지역 매출이 차지하는 비중은 약 60%로 가장 크다.
삼성바이오에피스는 블록버스터(연 매출액 100억달러 이상) 약물의 바이오시밀러 허가를 따냈지만 평소와 달리 허가 소식을 공개하지 않은 등 대외 활동에 거리를 두고 있다. 향후 계획을 묻는 질문에는 모두 "대외비로 알려줄 수 없다"는 입장을 고수하고 있다.
오퓨비즈의 미국 내 판매를 담당하는 미국계 파트너사인 바이오젠 측도 마찬가지로 이와 관련한 물음에 "오퓨비즈의 예상 출시 시기를 밝힐 수 없으며 적절한 때가 되면 알려드리겠다"며 말을 아꼈다.
삼성바이오에피스와 바이오젠이 이처럼 오퓨비즈에 관한 문의에 민감하게 대응하는 이유는 리제네론과 특허분쟁이 아직 끝나지 않았기 때문이다.
리제네론은 지난해 11월 삼성바이오에피스가 아일리아와 관련한 특허 37개를 침해했다고 주장하며 회사를 제소했다. 이후 리제네론은 아일리아의 미국 내 독점 판매기한이 만료되는 날짜가 다가오자 이달 법원에 '임시제한명령(TRO)'을 발부해 줄 것을 요청했다.
지난 17일 법원은 리제네론의 요구를 인용해 TRO를 발부했고 삼성바이오에피스는 FDA로부터 오퓨비즈의 허가를 받았지만 미국 내 제품 출시가 일시적으로 금지됐다.
법원은 통상 14일 내로 양측의 의견을 듣는 청문회를 열고 '예비적 금지명령(PI)'을 발부할지 여부를 결정하는 데, PI가 승인되면 삼성바이오에피스는 특허소송이 진행되는 동안 오퓨비즈를 미국에 출시할 수 없게 된다.
바이오시밀러 업계 관계자는 "리제네론이 예상보다 끈질기게 바이오시밀러 출시를 막고 있는 상황"이라며 "삼성바이오에피스는 사소한 법적 시비에 휘말리지 않기 위해 대외 발언을 최대한 자제하고 있는 것으로 보인다"고 했다.
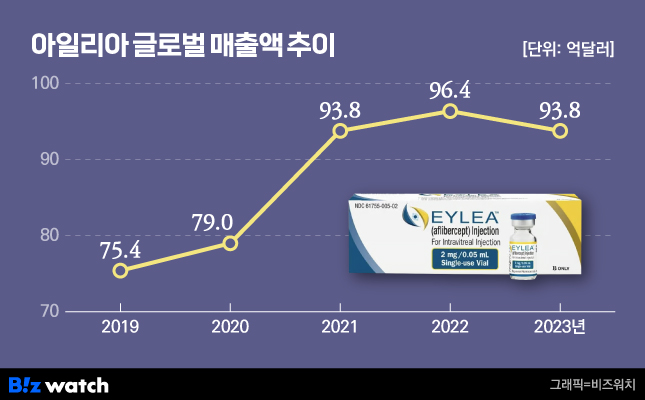
리제네론이 바이오시밀러 출시를 필사적으로 막는 이유는 아일리아에 대한 매출 의존도가 높기 때문이다. 리제네론은 지난해 전체 매출액에서 아일리아가 차지하는 비중이 약 70%에 달하는 가운데 이를 대체할 후속 약물은 없는 상황이다.
삼성바이오에피스가 현재 진행 중인 소송에서 이겨도 리제네론이 상급법원에 항소하면 오퓨비즈 출시 시기가 추가로 지연될 수 있다. 리제네론은 지난해 아일리아 바이오시밀러를 개발하던 바이오콘과 특허소송에서 일부 패소하자 상급법원에 항소한 바 있다.
소송이 장기화하면 양측 모두 법률적 비용부담이 커지는 만큼 출시시기 등을 조율하는 특허합의가 유일한 대안으로 꼽히나, 리네제론이 여전히 강경한 태도를 보이며 실현 가능할 지는 아직 불투명하다.
삼성바이오에피스 관계자는 "특허합의 여부나 출시 시기 등은 모두 대외비로 현재로서는 아무것도 말씀드릴 수 없다"고 했다.
리제네론 측은 삼성바이오에피스와 특허합의를 할 용의가 있느냐는 문의에 "우리는 아일리아를 개발하고 관련한 여러 특허를 취득하기 위해 수년의 노력을 쏟아부었다"며 "자사의 지적 재산권을 침해하는 것에 적극적으로(actively) 대응할 것"이라고 답했다.























