
전문의약품, 제네릭의약품, 의료기기 등 미국에서 식품의약국(FDA) 허가를 받기 위해 필요한 심사비용이 오는 10월 1일부터 전반적으로 인상되는 가운데 바이오시밀러 허가심사비용은 큰 폭으로 감소된다.
미국 식품의약국(FDA)은 2024년 회계연도 허가심사수수료를 확정, 발표했다. FDA는 매년 인플레이션, 심사 신청건수, 제조시설수 등을 감안해 이용자인 기업으로부터 받는 허가심사수수료를 책정하고 있다.
2024년도 회계연도는 2023년 10월부터 2024년 9월까지 적용된다. 오는 10월 1일부터 적용되는 전문의약품에 대한 2024년도 허가심사 수수료는 2023년도 보다 24.9% 인상된 404만8695달러(환율 1307원 적용시 한화 약 52억9100만원)로 사상 처음으로 400만 달러를 돌파했다. 전문의약품의 경우 전문의약품 이용자부담금법(PDUFA: Prescription Drug User Fee Act)에 따라 정해지며, 임상시험 자료 검토가 필요없을 경우 비용은 반으로 줄어든다.
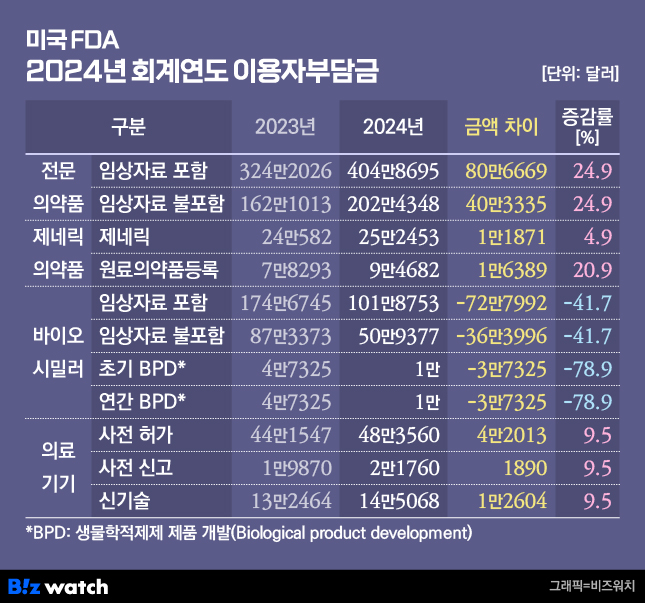
제네릭의약품은 25만2453달러로 2023년도 보다 4.9% 인상됐다. 제네릭의약품의 경우 제네릭의약품 이용자부담금개정법(GDUFA: Generic Drug User Fee Amendments)에 따라 정해지고 원료의약품 또는 완제의약품 시설이 해외 및 국내 소재 여부에 따라 비용에 차이가 난다.
의료기기는 사전 허가시 48만3560달러, 사전 신고시 2만1760달러, 신기술은 14만5068원으로, 모두 2023년도보다 9.5% 인상됐다.
반면 바이오시밀러 허가심사 수수료는 41.7% 인하돼 임상자료 포함시 101만8753달러, 임상자료 불포함시 50만9377달러가 책정됐다. 바이오시밀러 역시 바이오시밀러 이용자부담금개정법(BsUFA: Biosimilar User Fee Amendments)에 따라 전문의약품과 마찬가지로 임상자료 심사 필요 여부에 따라 금액차이가 2배 난다.
이와 관련해 한국바이오협회는 2023년에 이월된 약 2000만 달러의 바이오시밀러 운영비가 2024년 예산에 반영되면서 바이오시밀러의 허가심사 비용이 크게 낮아진 것으로 분석했다.
한국바이오협회 관계자는 "2024년도 바이오시밀러 허가심사수수료 산정을 위한 시뮬레이션에서 2024년도에는 기업으로부터 임상자료가 포함된 14개의 바이오시밀러 허가심사 신청이 있을 것으로 예측됐다"면서 "새롭게 23개가 생물학적제제 제품 개발(BPD)에 진입(초기 BPD)하고, 97개가 연례 BPD에 적용되는 등 총 120개의 BPD가 예상돼 2024년에도 미국 내 바이오시밀러에 대한 개발과 허가가 활발히 진행될 것으로 전망된다"고 했다.





















