
국내 제약바이오 기업들의 통풍치료제 개발에 연이어 제동이 걸리고 있다. LG화학이 중국과 유럽에서 통풍치료제 임상 계획을 철회한 데 이어 JW중외제약의 대만 임상 계획에도 차질이 생겼다. 다만 이들 기업은 임상 디자인을 수정해 통풍치료제 개발을 지속한다는 목표다.
JW중외제약은 대만식품의약품청(TFDA)으로부터 통풍치료제 후보물질 '에파미뉴라드(URC102)'의 임상3상 임상시험계획(IND)을 거절당했다고 2일 공시했다. 앞서 회사는 지난해 12월 TFDA에 통풍 환자를 대상으로 에파미뉴라드의 유효성 및 안전성을 페북소스타트 성분의 기존 통풍치료제와 비교하는 임상3상 IND를 신청한 바 있다.
통풍은 혈액 내 단백질 찌꺼기인 요산의 농도가 높아지면서 관절이나 관절 주위 조직에 염증이 생기는 질환이다. 돌발적인 통증과 붉게 부어오르는 증상 등이 나타나는데, 심한 경우 스치기만 해도 통증이 극심하고 온몸에서 열이 난다.
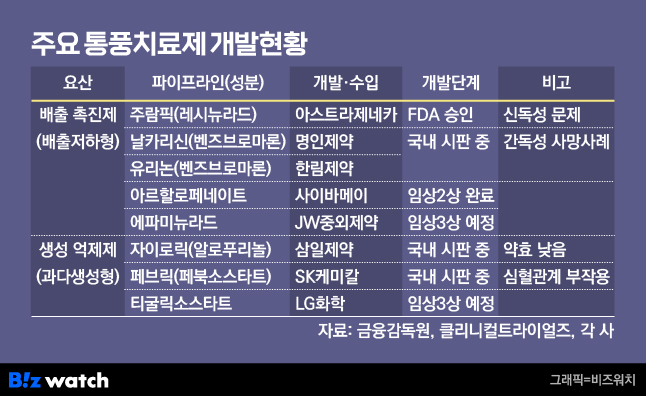
통풍의 원인은 크게 △요산 과다 생성과 △요산 배출 저하로 나뉜다. 이에 따라 통풍치료제도 '요산의 생성을 억제'하는 기전과 '요산의 배출을 촉진'하는 기전으로 개발되고 있다. 현재 개발된 요산 생성 억제제 약물로는 알로푸리놀 성분의 '자이로릭', 페북소스타트 성분의 '페브릭' 등이 있다. 레시뉴라드 성분의 '주람픽', 벤즈브로마론 성분의 '날카리신', '유리논' 등은 요산 배출 촉진제 약물에 속한다.
에파미뉴라드는 요산 배출을 촉진하는 기전의 통풍치료제 후보물질이다. 국내 통풍 환자 171명을 대상으로 에파미뉴라드(9㎎·6㎎·3㎎)와 위약 및 기존 치료제(페북소스타트 성분)를 비교한 국내 임상2b상에서 1차 평가변수(약물 투여 후 4주 시점에서의 혈청요산수치 6㎎/㎗ 이하 달성률)를 충족했다.
공시에 따르면 이번 대만 IND가 거절된 이유는 대조약에 대한 기준이 부적합했기 때문이다. 이와 관련 회사 측은 "대만의 경우 임상 계획에 대해 사전에 협의하는 절차(pre-IND)가 없어서 IND 신청 시 국내 식품의약품안전처 가이드라인에 맞춰 제출했다"면서 "임상의 목적이나 디자인에는 문제가 없고 대조약이 TFDA 가이드라인에 준하는 제조국 허가 기준에 부합하지 못한 것이라 대조약만 변경하면 된다"고 했다.
회사는 페북소스타트 성분의 통풍치료제 중 TFDA 가이드라인에 속한 치료제로 대조약을 변경, 4개월 내로 TFDA에 IND 재신청을 한다는 계획이다. 또 상반기 안에 유럽 허가 기관에 IND를 제출, 에파미뉴라드의 임상3상을 이어갈 예정이다. 국내의 경우 지난해 11월 식약처로부터 임상3상 IND를 승인받아 현재 환자를 모집 중이다.
요산 배출 촉진제 기전으로 통풍치료제를 개발하고 있는 LG화학 역시 최근 임상 계획에 차질을 빚고 있다. LG화학은 지난해 11월 통풍치료제 후보물질 '티굴릭소스타트(LC350189)'의 중국 임상3상을 중단한 데 이어 지난 1월 유럽 임상3상 IND를 철회한다고 밝혔다.
당시 회사는 유럽 임상을 자진 철회한 이유로 "임상 디자인이 미국 식품의약국(FDA)와 협의한 내용 및 유럽의약품청(EMA) 가이드라인에 근거해 설계됐으나 유럽 임상 승인 기관으로부터 임상 디자인 수정 의견을 받았다"면서 "추가 협의를 통해 유럽 IND를 재신청할 것"이라고 설명했다.
다만 LG화학은 지난달 28일 식약처로부터 티굴릭소스타트의 임상3상 IND를 승인받으면서 국내 임상에 속도를 내고 있다. 중국의 경우 지난해 12월 티굴릭소스타트의 중국 지역 개발 및 상업화 독점 권리를 중국 이노벤트 바이오로직스(이하 이노벤트)에 이전하면서, 파트너사를 통해 개발에 나설 예정이다. 또 FDA에 IND를 신청해 미국에서도 임상을 진행한다는 구상이다.
잇단 걸림돌에도 국내 기업들이 통풍치료제 개발을 지속하는 이유는 기존 통풍치료제의 한계가 명확해서다. 요산 생성 억제제 약물 중 알로푸리놀 성분은 요산 생성 억제 효과가 상대적으로 낮다고 알려졌다. 같은 기전의 페북소스타트 성분은 심혈관계 부작용 위험성이 제기되면서 FDA가 1차 치료제에서 제외한 상황이다.
요산 배출 저하형 통풍은 미충족 의료 수요가 더욱 높다. 전체 통풍 환자의 90%가 요산 배출 저하형 환자인 반면, 기존 요산 배출 촉진제 기전의 약물은 안전성 우려로 처방이 거의 이뤄지지 않고 있어서다. 레시뉴라드 성분의 경우 신독성 문제로 저용량 병용요법으로만 FDA 승인을 받았다. 벤즈브로마론 성분은 간독성 사망 사례가 발생하면서 FDA 승인에 실패했다. 현재 일본과 한국 등 일부 국가에서만 벤즈브로마론 성분의 통풍치료제를 처방 중이다.
업계 관계자는 "육류 섭취나 과음, 과식 등으로 통풍 환자가 전 세계적으로 빠르게 증가하는 추세"라며 "기존 치료제의 한계가 명확한 만큼 안전하고 효과적인 치료제에 대한 수요가 높은 상황"이라고 했다.






















