국내 보건당국이 모더나 코로나19 백신을 국가출하승인하면서 본격적으로 국내에서 모더나 접종이 시작됐다. 이로써 국내에 공급하고 있는 백신은 아스트라제네카(AZ), 화이자, 얀센, 모더나 등 4종류로 늘어났다.
식품의약품안전처는 GC녹십자가 신청한 '모더나코비드-19백신주' 5만5000회분을 국가출하승인했다고 16일 밝혔다. 국내 모더나 백신 수입분의 첫 국가출하승인이다. 모더나 백신은 지난달 21일 식약처로부터 수입품목 허가를 받은 이후 국가출하승인 단계만 남겨두고 있었다.
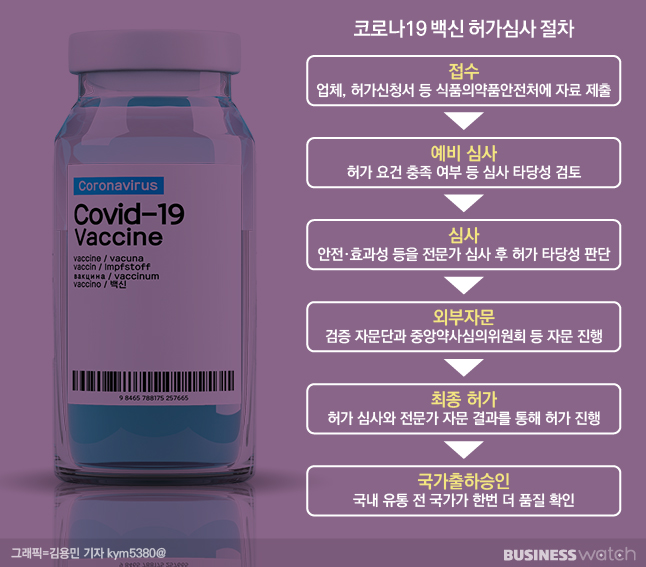
국가출하승인은 백신을 유통‧판매하기 전에 국가가 한 번 더 품질을 확인하는 절차다. 백신은 건강한 영·유아나 일반인 등 불특정 다수에게 접종하기 때문에 안전사고가 발생했을 때 미치는 파급효과가 크다. 생물을 재료로 만든 생물학적 제제인 만큼 품질의 일관성도 담보하기 어려워 동일한 제조공정에서 제조한 백신의 제조단위별로 품질을 확인해야 한다.
식약처가 이번에 허가한 단계는 코로나19 백신의 허가심사 절차 6단계 중 마지막 단계다. 앞서 식약처는 임상시험 최종결과보고서 등을 제출하는 조건으로 모더나 백신의 수입품목 허가를 승인을 했다. 하지만 모더나 측이 미국에 백신을 우선 공급하기로 결정하면서 국내 공급 일정은 미뤄진 상태였다.
식약처는 국가출하승인을 통해 모더나 백신의 효과성과 안전성, 품질 등을 확인했다. 식약처는 "모더나 백신 5만 5000회분에 대한 검정시험과 제조‧시험 자료검토 결과 효과성, 안전성, 품질의 일관성을 확인했다"며 "국가출하승인 기준에 적합해 출하승인을 결정했다"고 밝혔다.
이에 따라 국내 유통을 맡은 GC녹십자는 모더나 백신을 전국 45개 상급종합병원에 배송했다. 대상은 상급종합병원 소속 30세 미만 보건의료인과 의대생·간호대생 등 예비의료인이다. 30세 미만 보건의료인은 당초 아스트라제네카(AZ) 백신 접종 대상이었으나 혈소판 감소성 혈전증(TTS) 발생 우려로 접종에서 제외된 바 있다.
모더나 백신은 화이자 백신과 같은 메신저 리보핵산(mRNA) 백신이다. 모더나 백신이 공급되면서 국내에서 접종하는 백신은 아스트라제네카, 화이자, 얀센, 모더나 등 4종류로 늘어났다. 정부가 도입하기로 한 백신 5종류 중 하나인 노바백스는 아직 전 세계적으로 승인이 나지 않고 있다.
한편 정부는 지난 17일 '3분기 코로나 예방 접종 계획'을 발표하고 9월까지 최소 2200만명을 접종하겠다는 목표를 내놓았다. 하지만 연령대나 집단별로 어떤 백신을 맞을지에 대한 구체적인 공급계획은 아직 나오지 않은 상태다. 지난 17일 기준 국내 누적 1차 접종자는 1423만3045명으로 1차 접종률은 27.7%다.