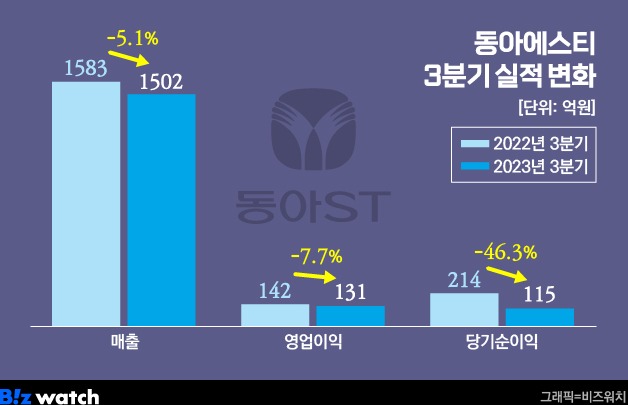
동아에스티가 지난 24일 식품의약품안전처로부터 면역항암제 후보물질 'DA-4505'의 1·2a상 임상시험계획(IND)을 승인받았다고 27일 밝혔다. DA-4505는 면역반응을 조절해 종양세포가 면역세포로부터 공격받는 것을 방해하는 인자인 아릴탄화수소수용체(AhR)를 억제하는 기전의 치료제다.
동아에스티는 이번 임상에서 국소 진행성 또는 전이성 고형암 성인 환자를 대상으로 DA-4505 단독요법과 항 세포예정사 단백질(PD)-1 면역관문억제제인 '키트루다(성분명 펨브롤리주맙)' 병용요법의 안전성과 내약성, 약동학, 약력학 및 유효성을 평가할 계획이다.
동아에스티는 전임상 단계에서 DA-4505가 AhR을 저해해 종양미세환경에서 억제된 면역반응을 복구하고 수지상세포, T세포 등 자극성 면역세포를 활성화해 암세포가 면역을 억제하는 기능을 감소시킨 것을 확인했다. 특히 DA-4505는 글로벌 제약사가 개발 중인 AhR 길항제와 비교해 개선된 종양 억제 효과를 나타냈으며, 키트루다와 병용투여 시 보다 뛰어난 종양 억제 효과를 보였다.
동아에스티 관계자는 "전임상에서 뛰어난 종양 억제 효과를 확인하며 기존 면역항암제의 한계를 극복할 수 있는 DA-4505의 가능성을 확인했다"며 "DA-4505의 임상 1/2a상을 성공적으로 끝마칠 수 있도록 최선을 다하겠다"고 했다.