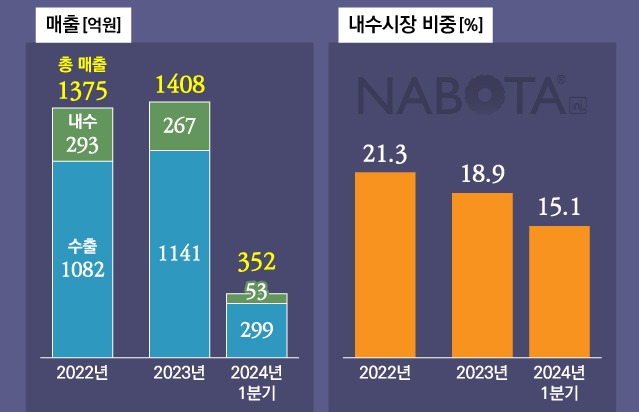
대웅제약이 보툴리눔톡신 제제 '나보타'를 미용에서 치료영역으로 시장을 확대하기 위해 속도를 내고 있다.
15일 대웅제약에 따르면 '나보타'의 미국 파트너사 이온바이오파마는 미국에서 보툴리눔 톡신 ABP-450(미국 제품명: 주보)의 만성 편두통 임상 2상 환자 등록을 마쳤다.
만성 편두통 임상 2상의 환자 등록이 조기에 완료됨에 따라 당초 오는 2024년 하반기에 발표할 예정이었던 임상 데이터 발표 시기도 내년 3분기로 앞당겨질 예정이다.
이번 임상 2상에서 이온바이오파마는 미국, 캐나다, 호주의 약 50개 지역에서 총 492명의 환자를 대상으로 성인의 만성 편두통 치료를 위한 효능과 안전성을 평가한다.
무작위, 이중맹검, 위약대조 형식으로 한 달 기준 15일 이상의 두통과 최소 8일 이상의 편두통을 겪는 성인이 대상으로, 환자군은 저용량(150 유닛) 투약군, 고용량(195 유닛) 투약군, 위약군 등 총 세 집단으로 분류된다. 또 이번 임상 2상에서는 이온바이오파마가 자체 개발한 신규 주사법을 활용해 경쟁 제품 대비 더 적은 횟수로 주사한다.
대웅제약은 치료 이력이 없는 환자가 70% 를 넘었던 삽화성 편두통 임상에 비해 만성 편두통 임상 시험은 치료 이력이 있는 환자의 비중이 더 높아 위약효과가 더 낮게 나타날 것으로 보고 있다.
앞서 대웅제약은 지난 9월 미국에서 나보타의 '편두통 치료용 신경독소 조성물'에 대한 특허를 획득하면서 오는 2041년까지 독점적 권리를 보호받을 수 있게 됐다. 이온바이오파마는 기존 보툴리눔 톡신 제제에 비해 투여 횟수를 줄이고 투여 위치도 변경해 사용 편의성 개선과 부작용 감소 등을 인정받아 특허를 획득했다.
현재 나보타는 국내에서 미용분야에서 미간주름, 눈가주름, 사각턱(양성교근비대), 치료분야에서는 뇌졸중 후 상지근육경직, 눈꺼풀 경련 등 5개의 적응증을 보유하고 있다. 하지만 미국에서는 아직 미용분야로만 허가받은 상태다. 대웅제약은 글로벌 시장에서 만성 편두통 외에도 △경부 근긴장이상 △위마비 △외상 후 스트레스장애 등으로 치료 적응증을 확대하기 위한 임상을 진행 중이다.
이처럼 대웅제약이 나보타를 치료영역으로 적응증 확대에 속도를 내는 이유는 보툴리눔 톡신 제제의 치료영역이 미용영역보다 훨씬 크기 때문이다. 글로벌 시장조사 기관 포춘비즈니스인사이트에 따르면 지난해 글로벌 보툴리눔 톡신 시장은 65억달러(약 8조3000억원) 규모로, 이 중 치료비중이 53%를 차지하고 있다.
박성수 대웅제약 부사장은 "이온바이오파마와 긴밀한 협력을 통해 만성 편두통 임상 2상에 속도를 내고 있는 만큼 대웅제약 보툴리눔 톡신의 치료시장 진입도 머지 않았다"고 했다.