
지난해 식품의약품안전처 승인을 받은 국산 신약은 전무한 것으로 나타났다. 코로나 엔데믹에 돌입했지만 이전 3년간 지속된 코로나 확산으로 코로나 백신과 치료제 외에 다른 신약 개발이 좀처럼 진척되지 않은 영향이다.
지난 1999년 최초로 국산 신약으로 허가 받은 SK케미칼의 위암치료제 '선플라주'를 포함해 지난해까지 총 36개의 국산 신약이 식약처의 허가 승인을 받았다.
특히 코로나 확산 시기였던 2021년 △유한양행의 비소세포폐암 치료제 '렉라자' △셀트리온의 코로나 치료제 '렉키로나' △한미약품의 호중구감소증 치료제 '롤론티스' △대웅제약의 위식도역류질환 치료제 '펙수클루' 등 역대 두 번째로 많은 4개의 국산 신약이 탄생했고 2022년에도 SK바이오사이언스의 코로나 백신 '스카이코비원'과 대웅제약의 당뇨병 신약 '엔블로' 2개의 신약이 허가를 받았다.
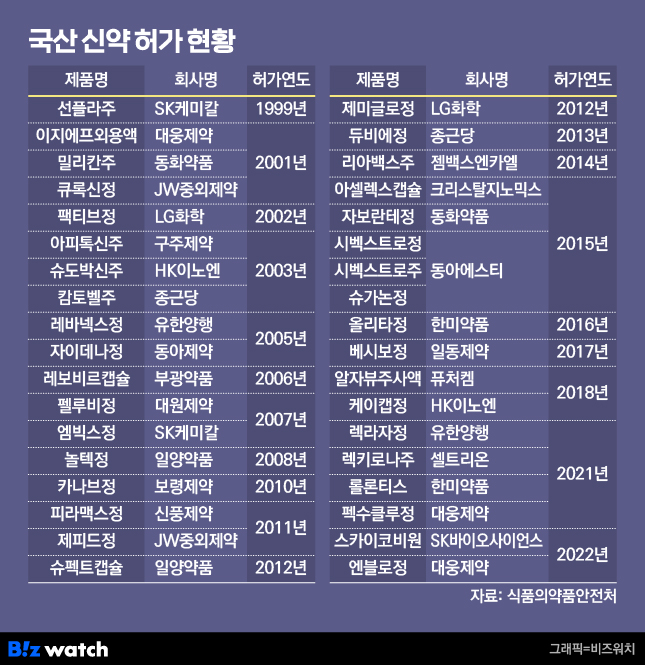
하지만 지난해는 코로나 엔데믹으로 주춤했던 신약 개발이 재개됐지만 허가 받은 국산 신약은 단 한 건도 없었다. 지난 2020년부터 2022년까지 코로나가 확산하면서 다수 제약바이오 기업들이 국산 코로나 백신과 치료제 개발에 뛰어들었고 정부의 품목허가 승인 역시 코로나 백신과 치료제 부문에 집중됐기 때문이다.
또 사회적 거리두기로 병원 방문이 제한되면서 임상진행에도 차질이 빚어지는 등 신약 연구개발(R&D)을 지속하기 어려운 환경이 지난해까지 이어진 영향도 있다. 업계 관계자는 "코로나 시기에 임상시험 진행이 어려워지면서 신약 개발이 주춤했지만 지난해 엔데믹으로 전환하면서 다시 임상개발도 활기를 되찾았다"면서 "올해 1~2개의 국산 신약이 탄생할 것으로 기대한다"고 했다.
현재 허가가 유력한 국산 신약은 제일약품 관계사 온코닉테라퓨틱스의 위식도 역류질환 치료제 '자스타프라잔(성분명)'이다. 자스타프라잔은 HK이노엔의 케이캡(성분명 테고프라잔)과 대웅제약의 펙스클루(성분명 펙수프라잔)와 같은 칼륨경쟁적 위산분비 억제제(P-CAB) 계열 위식도 역류질환 치료제다.
앞서 케이캡은 2018년 국산 신약 30호로, 펙수클루는 2021년 국산 신약 35호로 허가 받은 만큼 자스타프라잔도 국산 신약으로 허가 받을 가능성이 높다는 관측이다. 온코닉테라퓨틱스는 지난해 6월 식품의약품안전처에 자스타프라잔의 품목허가 승인을 신청했으며 올해 허가 여부가 결정될 전망이다.
동아에스티의 과민성 방광 치료 신약 'DA-8010'은 국내 임상3상을 진행 중으로 올해 상반기 3상을 완료하면 연내 품목허가를 신청할 확률이 높다. DA-8010은 임상시험에서 방광 선택성이 높아 부작용이 적고 기존 과민성 방광 치료제로 쓰이는 항무스카린제 대비 우수한 효능을 확인했다. 동아에스티는 DA-8010의 적응증 확대를 위해 지난해 추가 임상1상 시험계획(IND)도 제출한 상태다.
이와 함께 삼성제약이 지난해 5월 젬백스엔카엘로부터 국내 실시권을 취득한 알츠하이머병 치료제 'GV1001'도 국산 신약 후보로 거론된다. GV1001은 젬백스가 췌장암 치료제로 개발해 '리아백스'라는 이름으로 지난 2014년 9월 국산 신약 21호로 조건부 허가를 받았으나 지난 2020년 8월 품목허가 취소 처분을 받았다.
정식허가는 전임상(동물실험)부터 임상1~3상까지 모두 완료하고 임상결과 보고서를 제출해야 한다. 반면 조건부허가는 환자의 치료 기회를 확대하기 위해 임상2상을 마친 상태에서 정해진 기간 내 임상3상 시험 결과 보고서를 제출하는 조건으로 허가를 미리 해주는 제도다. 리아백스는 조건부 허가 기간이 만료됐음에도 임상시험 결과 보고서를 제출하지 않아 6년 만에 허가 취소와 함께 국산 신약 타이틀을 내려놔야 했다.
리아백스는 췌장암 치료제 임상3상을 마쳤지만 향후 약가 산정 등을 고려해 알츠하이머병 치료제를 최우선 적응증으로 내세우기 위한 전략을 펼치고 있다. 삼성제약은 지난 5일 전문가들의 의견을 반영해 GV1001의 3상 IND 변경을 신청했다. 삼성제약이 임상3상을 성공적으로 마칠 경우 다시 국산 신약 타이틀을 거머쥘 가능성이 높게 점쳐진다.

























