글로벌 제약사 애브비(AbbVie)의 c-Met(세포성장인자 수용체) 표적 항체약물복합체(ADC) 항암신약 '엠렐리스(Emrelis)'가 폐암 치료제로 미국 식품의약국(FDA) 승인을 획득했다.
c-Met을 표적하는 ADC 치료제의 첫 허가다. 이에 따라 글로벌제약사인 로슈를 비롯해 국내 셀트리온, 종근당 등의 후속 약물 개발에도 속도가 붙을 전망이다.
14일(현지시간) 미국 FDA는 엠렐리스를 c-Met 단백질이 과발현하는 진행성, 전이성 비소세포폐암 환자의 치료제로 신속 승인했다. FDA는 이와 함께 c-Met 단백질 과발현을 탐지하는 보조 진단 검사로 로슈 진단의 'VENTANA MET(SP44) RxDx Assay'도 승인했다.
엠렐리스는 치료제가 시급히 필요한 중증 질환의 신약을 빠르게 허가하는 신속 승인(Accelerated Approval Program) 제도의 혜택을 받았다.
FDA는 c-Met 수치가 높은 환자에서 35%의 종양 감소 효과(전체반응률)과 7.2개월의 약물반응 지속기간(DOR) 등의 2상 결과를 검토해 허가를 결정했다. FDA는 엠렐리스의 부작용을 추적 관찰하면서 애브비가 진행중인 3상 종료 후 최종 승인 여부를 결정할 예정이다.
c-MET은 각종 고형암에서 발현하는 유망한 항암 표적이었지만 부작용 등의 이슈로 실패를 거듭하다 효능과 안전성을 높일 수 있는 ADC에 적용되면서 다시 주목받고 있다. 애브비에 따르면 c-MET 단백질은 비소세포폐암 환자의 25%에서 과발현될 만큼 빈도가 높다.
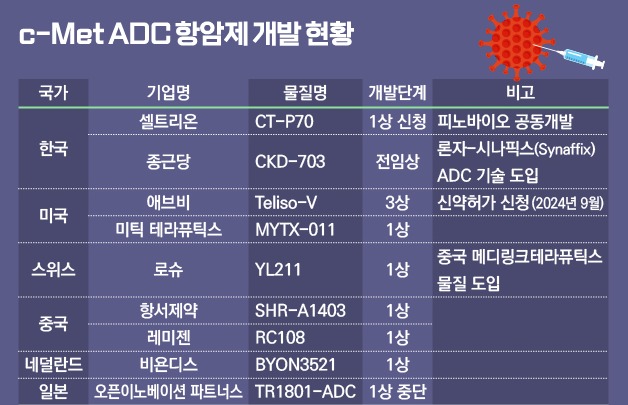
셀트리온·종근당 등 c-Met ADC 개발 탄력
이번 엠렐리스 최초 허가에 따라 계열내 최고 치료제(Best-in-class)를 개발하려는 후발주자들의 속도도 빨라질 전망이다.
엠렐리스는 임상 과정에서 피로, 오심, 어지러움 등의 가벼운 부작용뿐 아니라 말초 신경병증(peripheral neuropathy) 등의 중대한 부작용도 보였다. 또한 약물 증량 과정에서 독성이 관찰돼 고용량 투여가 제한되는 등 뚜렷한 한계가 존재해 후속 약물의 개발이 요구된다.
셀트리온은 지난달 미국 FDA로부터 c-Met ADC 항암신약 CT-P70의 글로벌 임상 1상 시험계획서를 승인받았다. 셀트리온은 CT-P70에 안전성과 효능을 높인 신규 항암물질을 적용해 경쟁약물과 차별화했다. 셀트리온은 CT-P70을 핵심 파이프라인으로 개발하고 있으며 연내 환자 투여를 시작할 예정이다.
ADC 치료제 개발기업으로 도약하려는 종근당도 네덜란드 시나픽스의 ADC 기술을 도입해 c-Met ADC 'CKD-703'을 개발하고 있다. CKD-703 전임상에서 높은 혈중 안정성과 내약성을 통한 항종양 활성화 효과를 확인했다. 연내 임상 1상 시험계획서를 제출할 계획이다.

이외에도 로슈는 지난해 1월 중국 메디링크테라퓨틱스에서 임상 1상을 진행하던 YL211을 도입해 개발하고 있으며 미틱 테라퓨틱스, 항서제약, 레미젠, 비욘디스 등도 1상을 진행하고 있다.
업계 관계자는 "엠렐리스는 부작용 문제로 저용량으로 투여할 수밖에 없는 한계점이 있다"면서 "이를 후발주자들이 극복한다면 다양한 적응증으로의 확장, 타 치료제와의 병용투여 등 새로운 기회를 잡을 수 있을 것"이라고 말했다.