
중국 제약바이오 기업이 개발한 바이오시밀러가 처음으로 미국 시장을 뚫었다. 점점 치열해지는 경쟁에서 국내 제약바이오 기업들의 입지가 좁아질 수 있다는 우려가 나온다.
21일 업계에 따르면 중국 바이오테라 솔루션즈(Bio-Thera Solutions)사는 최근 미국 식품의약국(FDA)으로부터 자사가 개발한 아바스틴 (Avastin, 성분명: 베바시주맙) 바이오시밀러인 '아브지비(Avzivi)'에 대한 품목허가를 승인받았다. 중국 기업이 FDA로부터 바이오시밀러 승인을 받은 건 이번이 처음이다.
오리지널 의약품인 아바스틴은 제넨텍(현재 로슈)이 개발한 표적항암제다. 지난 2004년 출시해 전이성 대장암, 비소세포폐암 등에 사용되고 있다.
12월 현재 FDA가 허가한 바이오시밀러는 총 45개로, 아바스틴 바이오시밀러는 지난해 9월 허가받은 셀트리온의 '베그젤마'와 이번에 허가 받은 중국의 '아브지비'를 포함해 총 5개다. 삼성바이오에피스는 2019년 FDA에 아바스틴 바이오시밀러 '에이빈시오(한국 제품명: 온베브지)'의 품목허가를 신청했지만 아직 승인이 나지 않은 상태다.
오리지널과 바이오시밀러를 포함한 베바시주맙의 글로벌 시장 규모는 2021년 64억3530만달러(한화 약 8조3600억원)로, 미국이 약 26억200만달러(약 3조 3800억원), 유럽이 16억1400만달러(약 2조1000억원)를 차지하고 있다.
특히 중국의 바이오시밀러 개발이 활발하게 이뤄지고 있어 아바스틴뿐만 아니라 바이오시밀러 전체 시장 경쟁도 한층 달아오를 전망이다.
한국바이오협회에 따르면 중국 내에서 허가된 바이오시밀러는 지난 8월 기준 총 34개였으며, 개발 중인 바이오시밀러는 단일클론항체만 132개(2023년 2월 기준)에 달한다. 이번에 미국에서 허가받은 바이오테라의 경우 임상 개발단계에 있는 바이오시밀러만 20개 이상인 것으로 알려졌다.
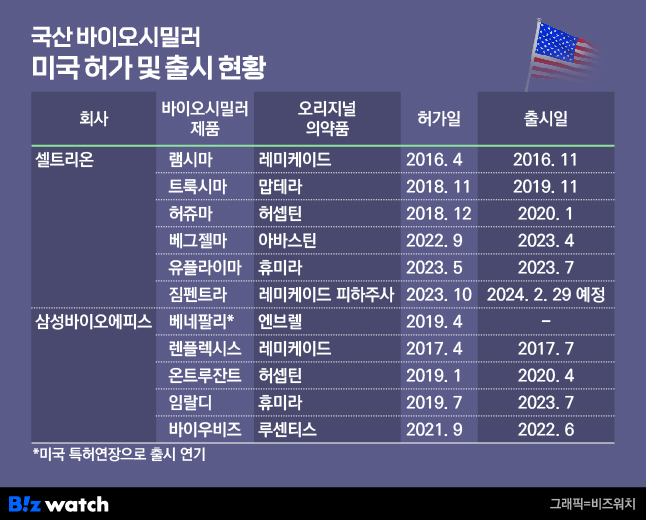
국내 대표 바이오시밀러 기업인 셀트리온과 삼성바이오에피스가 미국에 출시한 바이오시밀러는 현재 각각 5개와 4개다. 셀트리온은 램시마, 트룩시마, 허쥬마, 베그젤마, 유플라이마에 이어 내년 2월 29일 램시마의 피하주사 제형인 '짐펜트라(국내명 램시마SC)' 출시를 앞두고 있다.
삼성바이오에피스의 경우 베네팔리, 렌플렉시스, 온트루잔트, 임랄디, 바이우비즈 등 5개 품목허가 승인을 받았지만, 베네팔리의 경우 오리지널 의약품인 엔브렐의 미국 특허연장으로 출시가 2029년 이후에나 가능할 전망이다.
중국 기업들의 바이오시밀러 개발과 진출이 본격화되면서 국산 바이오시밀러의 입지도 좁아질 수 있다는 관측이 나온다. 국내 기업들이 글로벌 기업보다 경쟁력 있는 가격을 내세우면서 시장을 확대하고 있지만 중국의 경우 더 낮은 약가를 내세울 가능성이 크기 때문이다. 다만 미국 시장 특성상 처방 우위를 차지하는 건 보험사 등재 여부에 달려있다.
업계 관계자는 "중국 바이오시밀러는 이제 막 미국 시장에 진입해 인지도나 신뢰도가 낮다"면서 "그러나 미국 처방 시장은 공보험과 사보험 등재 여부가 관건인 만큼 언제 판도가 뒤집힐 지 알 수 없다"고 했다.

























