'의약품 허가특허 연계제도'가 올해로 도입 7년차를 맞았다. 의약품 허가특허 연계제도란 의약품 품목허가 과정에서 특허권 침해 여부를 고려하는 제도다. 복제의약품(제네릭)의 허가 단계에서 사전에 특허권 침해 여부를 판별해 제네릭의 생산·판매를 차단하거나 독점 판매권을 인정해주는 내용이다.
국내 보건당국은 한·미 자유무역협정(FTA)에 따라 지난 2015년 3월부터 의약품 허가특허 연계제도를 시행했다. 미국에 대형 글로벌 제약기업들이 많은 만큼 미국이 자국 기업들의 특허권을 보호하기 위해 요구한 제도다.
과거에는 식품의약품안전처가 국내 기업들이 복제의약품(제네릭) 시판 허가신청을 하면 의약품의 안전성과 유효성만으로도 허가를 냈다. 이후 오리지널사가 특허소송을 제기해 승소하면 허가를 취소하는 방식이었다.
의약품 특허는 복잡한 구조로 이뤄져 있다. 국내에서 약사법에 따라 등재 가능한 의약품 특허는 △물질특허 △제형특허 △조성물특허 △용도특허 등이다. 물질특허는 의약품에 포함된 성분, 제형특허는 주사제, 정제, 연고제 등 의약품 형태에 관한 특허다. 조성물특허는 여러 가지 성분을 복합하는 과정에서 성분 배합 방법이나 함량 및 비율, 용도 특허는 의약품 효능‧효과, 용법‧용량, 기전 등에 관한 특허를 말한다.
허가특허 연계제도 시행 이후 국내 제약바이오 업계에서 특허는 매우 중요한 의미를 갖게 됐다. 혁신 신약 개발 역량이 부족한 국내 제약바이오기업들의 주요 매출원은 오리지널 의약품을 복제한 제네릭이다. 제네릭을 출시하기 위해서는 오리지널 의약품 특허기한이 만료돼야 한다.

의약품 허가특허 연계제도에는 제네릭 판매금지 조항이 있다. 이는 특허권자를 보호하기 위해 특허소송 기간 동안 제네릭의 판매를 금지하는 내용을 담고 있다. 국내 기업에서 최초 제네릭 허가를 신청하면 식약처는 이 사실을 특허권자에게 통보해야 한다. 이때 특허권자(오리지널 기업)가 45일 이내에 특허침해 소송을 제기할 경우 식약처에 최대 9개월 간 해당 제네릭의 판매금지를 신청할 수 있다.
식약처의 허가특허 연계제도 영향평가 연구용역 보고서에 따르면 판매금지가 도입된 2015년 3월부터 2019년 12월까지 4년여 간 오리지널사가 제네릭 판매금지를 신청한 건수는 138건이었다.
판매금지를 피하기 위해서는 국내 기업들은 오리지널 의약품의 특허 만료일이 종료되는 시점 이후에 제네릭을 출시해야 한다. 그러나 특허를 회피해 특허만료 전에 경쟁사들보다 먼저 제네릭 허가를 받을 수 있는 방법이 있다. '우선판매품목허가(우판권)' 제도다. 우선판매품목허가는 소송을 통해 특허도전에 성공한 제네릭이 9개월 동안 다른 경쟁 제네릭의 진입 없이 오리지널 의약품과 경쟁할 수 있도록 한 제도다.
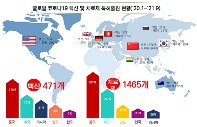
우판권을 받으려면 '최초 특허심판 청구'와 '최초 허가신청' 두 가지 요건을 충족해야 한다. 다만 이 제도의 허점은 14일 이내에만 청구하면 수십, 수백 곳의 기업 모두 최초 특허심판으로 인정한다는 점이다. 이 탓에 제도 시행 이후 의약품 특허소송은 급증했다. 특허‧소송정보 서비스 기업 코아제타에 따르면 2013년 전에는 연간 100건 미만이었던 특허소송이 허가특허 연계제도 시행 직후인 2015년에는 무려 1990건으로 늘어났다.
최초 특허심판 청구라는 의미가 무색하게도 우판권으로 실익을 얻는 기업은 거의 없는 셈이다. 오히려 기업들의 소송비용만 증가하게 만들었다. 이에 오랫동안 우판권 제도의 최초 특허심판 청구 개선을 요구하는 목소리가 높지만 아직 이렇다 할 제도 개선의 움직임은 없다.
업계 관계자는 "우판권 제도의 의도와 달리 우선적으로 시장에서 오리지널 의약품과 경쟁할 수 있는 메리트가 없다"며 "정부가 다양한 제네릭 난립 정책을 고심하고 있지만 제네릭 시장 경쟁을 원초적으로 차단할 수 있는 우판권 제도 개선부터 고려해야 한다"고 말했다.
현재도 다수 제약기업들이 제네릭 경쟁에서 우위를 차지하기 위해 계속 특허소송을 제기하고 있다. 제네릭 난립을 막고 기업들의 불필요한 소송을 막기 위해서는 우판권 제도 개선에 대한 적극적인 검토가 이뤄져야 한다는 의견이 많다.