
브릿지바이오테라퓨틱스(아래 브릿지바이오)의 특발성 폐섬유증(IPF) 치료제 후보물질 'BBT-877'이 미국식품의약국(FDA)으로부터 임상2상 임상시험계획(IND)을 승인받았다. BBT-877은 지난 2019년 독일 베링거인겔하임에 기술이전(L/O)했으나, 잠재적 독성 우려 문제로 권리가 반환된 이후 회사가 자체 개발에 나선 후보물질이다.
BBT-877의 임상2상이 본궤도에 오르면 L/O 관련 논의도 다시 활발해질 전망이다. 브릿지바이오 측은 이전 계약 규모를 상회하는 수준으로 BBT-877의 L/O 계약을 추가로 체결할 수 있을 것으로 기대하고 있다.
BBT-877 임상2상 진입 승인…"독성 이슈 해소"
25일 브릿지바이오테라퓨틱스에 따르면 지난 20일 FDA는 BBT-877의 임상2상 개시 계획을 최종 승인했다. BBT-877는 회사가 지난 2017년 레고켐바이오에서 도입한 IPF 치료제 후보물질이다. 지난 2019년 임상1상 단계에서 베링거인겔하임에 약 1조5000억원 규모로 L/O했지만, 2020년 잠재적 독성 우려 문제로 권리가 반환됐다. 이후 브릿지바이오는 추가 실험에서 독성 문제가 고농도 약물 처리에 따른 것으로 판단, 자체적으로 후보물질을 개발하기로 결정했다.
이번 FDA의 임상2상 승인으로 BBT-877의 잠재적 독성 우려는 모두 해소됐다. 앞서 회사는 지난 5월 BBT-877의 안전성을 다각도로 입증할 수 있는 추가 자료를 FDA에 모두 제출했다고 밝힌 바 있다. 추가 자료에는 약물 복용 후 DNA 손상 원인이 약물 자체의 유전 독성에 의한 직접적인 손상이 아닌, 고농도 약물 처리에 의한 간접적인 손상에 있다는 혜성분석 실험 결과가 포함됐다.
임상2상은 질병을 가진 소규모 환자를 대상으로 약물의 효능과 최적의 용법·용량을 정하는 과정이다. 브릿지바이오는 추가적인 비임상시험이나 기존 계획에 대한 중대한 변경 없이 임상2상을 진행할 수 있게 됐다. 이번 임상2상은 한국과 미국 등 전 세계 약 8개 국가에서 진행한다. 회사는 지난 5월과 6월 두 차례에 걸친 제3자배정 유상증자를 통해 임상시험에 필요한 운영자금 약 486억원을 확보하기도 했다.
브릿지바이오는 임상2상에 빠르게 진입하는 데 주력할 예정이다. 회사 측은 "IPF 질환 관련 경험이 풍부한 임상시험 수탁기관(CRO)과 BBT-877의 임상2상을 위한 계약 절차를 모두 마쳤다"면서 "시험 개시에 필요한 준비 과정을 조속히 마무리해 이르면 8월께 첫 임상시험 기관 활성화 및 환자 모집 단계에 들어갈 것"이라고 밝혔다.
오토택신 저해제 '선두주자' 노린다
IPF는 알 수 없는 이유로 섬유 조직이 과도하게 생성되면서 폐가 딱딱하게 굳어가는(섬유화되는) 병이다. 진단 후 5년 생존율이 40% 미만인 희소질환이다. 전 세계적으로 약 300만명의 환자가 있으며, 국내의 경우 지난해 기준 약 1만8000명의 환자가 있는 것으로 알려졌다. 유진투자증권은 IPF 치료제 시장이 오는 2027년 8조원에 달할 것으로 보고 있다.
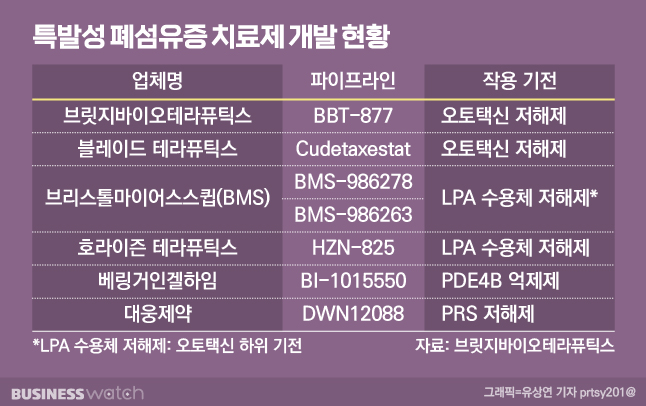
FDA 승인을 받은 IPF 치료제는 베링거인겔하임의 '오페브(성분명 닌테다닙)'와 로슈의 '에스브리엣(성분명 퍼페니돈)' 2개 품목밖에 없다. 각각 지난해 매출이 약 3조3000억원, 약 1조3000억원에 달하는 블록버스터 의약품이다. 다만 두 약물 모두 폐기능 저하를 늦출 뿐, 근본적인 치료 가능성이 낮아 미충족 의료 수요(unmet needs)가 높다. 게다가 오페브는 오는 2024년, 에스브리엣은 2026년에 특허가 만료된다. 현재 미국 블레이드 테라퓨틱스와 일라이 릴리, 국내에서는 대웅제약 등이 IPF 치료제를 개발 중이다.

브릿지바이오는 BBT-877를 오토택신 저해제로 개발하고 있다. 오토택신은 우리 몸에서 지방 신호물질로 알려진 리소포스파티드산(LPA)을 생성하는 일종의 효소 단백질이다. LPA가 몸에서 과도하게 만들어지면 섬유화가 진행된다. BBT-877는 오토택신을 선택적으로 저해해 섬유화를 막는 효과를 낸다. 임상1상 결과 BBT-877가 체내 LPA 농도를 최대 90% 수준까지 억제했다는 게 회사 측의 설명이다.
특히 BBT-877이 오는 3분기 내 임상2상에 진입하면 오토택신 저해제 계열 후보물질 중 개발 속도가 가장 앞선 '계열 내 최초(first in class)' 타이틀을 되찾게 된다. 제약바이오 업계에선 오토택신 저해제 계열 치료제 시장을 선점하기 위한 경쟁이 치열하다. 갈라파고스가 지난해 2월 동일 계열 IPF 치료제 후보물질 'GLPG1690'의 임상3상을 중단하면서 브릿지바이오는 선두주자로 떠올랐다.
또 다른 경쟁 업체론 블레이드 테라퓨틱스가 꼽힌다. 지난 1월 동일 계열 IPF 치료제 후보물질인 'BLD-0409'의 임상1상 종료를 발표, 브릿지바이오를 바짝 뒤쫓고 있다. 블레이드 테라퓨틱스에 따르면 BLD-0409를 기존 치료제와 병용 투여했을 때 안전성 및 우수한 내약성을 확인했다. BLD-0409 역시 임상2상 개시를 앞뒀다.
"BBT-877 가치 올랐다"…L/O 기대감
BBT-877가 잠재적 독성 우려를 해소하고 임상2상에 진입하면서 L/O 관련 기대도 커지고 있다. 회사 측은 "FDA 임상2상 승인에 따라 과제의 가치 상승 요인이 대폭 추가돼 이전 계약 규모를 상회하는 수준으로 재기술이전 계약을 체결할 수 있을 것"이라며 "주요 다국적 제약사를 비롯해 여러 제약바이오 업체와 사업 개발 논의가 재점화되고 있다"고 설명했다.
실제로 제약바이오 업계에선 한 번 반환된 후보물질을 다시 L/O하는 사례가 종종 나온다. 한미약품은 비만·당뇨 치료제 후보물질 'HM12525A'를 미국 얀센에 약 1조9000억원 규모로 L/O했다가 지난 2019년 권리를 돌려받았다. 이듬해 한미약품은 HM12525A를 비알코올성 지방간염(NASH)로 개발하는 조건으로 미국 머크(MSD)와 L/O 계약을 성사시켰다.
또 SK는 SK바이오팜 설립 이전인 2000년 우울증 치료제로 개발하던 '솔리암페톨'을 존슨앤드존슨(J&J)에 L/O한 바 있다. 이후 J&J가 임상 단계에서 효능 입증에 실패하면서 권리를 반환했지만, SK는 솔리암페톨의 적응증을 수면장애로 변경해 재개발에 나섰다. SK바이오팜은 솔리암페톨을 2011년 재즈파마슈티컬즈(전 에어리얼바이오파마)에 L/O하고 이어 2019년 FDA 품목허가를 받는 쾌거까지 이뤘다.
BBT-877은 임상1상 단계에서 단일 화합물 기준 최대 규모로 L/O에 성공했던 만큼 또다시 대형 거래를 이끌어낼 수 있을지 관심이 쏠린다. 이정규 브릿지바이오 대표는 "최근 코로나19 감염과 인구 노령화 등으로 인해 전 세계적으로 폐 섬유화 질환 영역에서 신약 개발 수요가 더욱 증가하고 있다"면서 "하루빨리 혁신 신약 개발 성과를 선보일 수 있도록 노력하겠다"고 말했다.


























