
전 세계 보건당국과 제약‧바이오 업계가 코로나19 백신과 치료제 연구개발에 혼신의 노력을 기울이고 있다. 코로나19 치료제와 백신 연구는 초미의 관심사다. 이에 최근 제약·바이오 기업들의 주가도 코로나19 치료제와 백신 개발의 연구 소식에 들썩인다. 시장은 “코로나19 치료에 효과적이라는 연구결과가 나왔다”는 한 마디에 마치 당장에라도 치료제와 백신이 상용화될 것처럼 반응한다.
그러나 신약 연구개발은 그리 간단치 않다. 여러 단계별 연구과정에서 신약의 안전성과 효능에 대한 결과는 언제든 뒤집힐 수 있다. 신약 개발 단계별 성공확률은 ▲ 전임상 69% ▲ 임상1상 54% ▲ 임상2상 34% ▲ 임상3상 70% 수준이다. 임상3상을 마쳤다고 해서 100% 허가가 이뤄지는 것도 아니다. 신약 허가신청(NDA)에 실패할 확률이 9%나 된다.
현재 국내에서 임상시험이 진행 중인 코로나19 치료제 및 백신은 치료제 13건, 백신 2건 등 총 15건이다. 기존에 진행 중이었던 임상시험 중 5건은 종료된 상태다.
길리어드사이언스가 진행한 '렘데시비르(제품명: 베클러리)'의 경우 중증과 중등도 환자를 대상으로 한 임상3상 2건은 유의미한 결과를 내고 종료됐다. 현재 국내에서 조건부허가를 받아 코로나19 환자들 치료에 사용되고 있다. 다만, 렘데시비르의 투약 요건은 코로나19 감염 환자 가운데 폐렴 증상으로 산소치료를 받고 있고 증상이 발생한 지 10일이 지나지 않은 환자들로 제한돼 있다.
아울러 '조건부허가'는 완전한 허가로 볼 수 없다. 조건부 허가는 안전성과 효과성이 입증된 의약품 중 환자 치료에 먼저 사용하고 허가에 필요한 자료를 나중에 제출토록 한 제도다. 길리어드사이언스는 현재 국제적으로 실시하고 있는 임상시험 최종 결과, 일부 제조·품질 관리기준(GMP) 자료, 추가 위해성 완화조치 등을 추가로 제출해야 한다. 임상 최종결과나 추가 자료를 충족하지 못할 경우 허가는 취소될 수 있다.
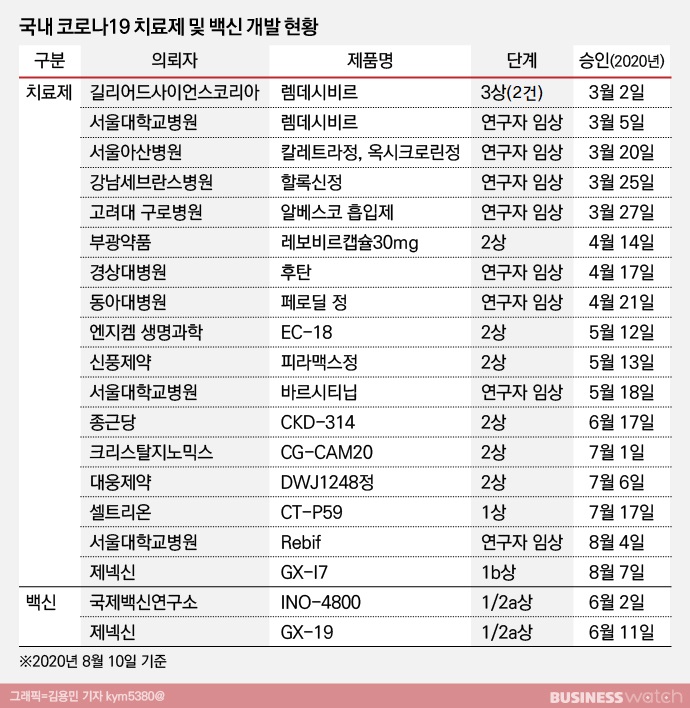
이밖에 렘데시비르의 조건부허가로 서울대병원이 진행하던 렘데시비르 연구도 종료됐다. 서울아산병원의 칼레트라정 및 옥시크로린정과 강남세브란스병원의 할록신정은 연구자임상에서 효능을 입증하는데 실패했다. 이로써 총 5건의 코로나19 치료제에 대한 연구가 종료된 상태다.
렘데시비르의 경우 임상3상까지 진행됐다. 반면 국내 제약·바이오 기업들의 경우 아직 임상3상에 다다른 물질은 단 한 개도 없다. 대부분이 성공확률이 가장 낮은 임상2상을 진행 중이다. 게다가 렘데시비르가 코로나19 치료제로 조건부허가를 받은 이상, 후속 치료제는 환자 대상군을 넓히거나 렘데시비르의 효과에 상당한 효능을 입증해야 하는 과제까지 더해졌다. 치료제 개발 및 허가 문턱이 더 높아졌다는 이야기다.
국제백신연구소와 제넥신이 연구 중인 코로나19 백신은 개발이 시급한 만큼 1상과 2상을 동시에 진행 중이다. 백신 역시 실패 가능성이 가장 높은 연구단계에 있어 성공 가능성을 장담하기 어렵다.
많은 제약·바이오 기업들이 높은 실패 위험 속에서도 코로나19 치료제와 백신 개발을 위해 사력을 다하고 있다. 환자들만큼이나 제약·바이오 기업 역시 코로나19 치료제와 백신 개발을 간절히 원하기 때문이다.
일각에서는 코로나19 치료제와 백신이 마치 개발된 것처럼 여론을 호도한다며 제약·바이오 기업들과 언론에 비난을 쏟아내기도 한다. 이는 신약 연구개발에 대해 잘 알지 못하는데서 나오는 오해다. 신약 개발은 복잡한 연구 단계를 거쳐야 한다. 그만큼 그 중간 과정에 대한 사실을 알릴 필요가 분명히 있다. 그래야 성패 가능성을 어느 정도 가늠할 수 있기 때문이다.
섣부른 판단에서 시작한 투자는 반드시 실패로 이어진다. 모두가 코로나19 치료제와 백신 개발을 간절히 바라고 있다. 그 간절함을 잘 알기에 제약·바이오업계도 치료제와 백신 개발에 총력전을 펼치고 있다. 검증되지 않은 한 마디에 '부화뇌동(附和雷同)'하기보다는 치료제와 백신 개발이 성공하기를 기다리는 것이 우선이다. 코로나19 치료제와 백신 개발은 비타민을 출시하는 것과는 다르다.























