
국내 제약·바이오 기업들이 해외 진출에 속도를 내고 있다. 국내 제약사만 200곳이 넘는 데다 잇단 약가 인하 정책으로 복제의약품(제네릭) 경쟁이 한계에 달하면서 내수 시장은 레드오션으로 변한 탓이다.
국내 제약·바이오 기업 중 처음으로 해외 진출에 성공한 품목은 지난 2003년 미국식품의약국(FDA)의 승인을 받은 LG생명과학의 항생제 '팩티브'였다. 이때부터 올해 상반기까지 FDA와 유럽의약품기구(EMA) 승인을 받은 품목은 각각 23개와 17개였다. 이중 13개 품목은 두 군데서 모두 허가를 받았다. 특히 2017년 7개, 2018년에 5개, 2019년엔 11개 품목이 두 기관의 심사를 통과하면서 해외 진출에 속도가 붙고 있다.
더 구체적으로 살펴보면 제네릭이나 개량신약 등 합성의약품은 EMA보다 FDA 승인이 더 빠르게 이뤄졌다. 우리나라 보건당국이 FDA의 의약품 허가심사 가이드라인을 따르고 있기 때문으로 분석된다. 여기에 우리나라의 제네릭 처방률은 54% 수준이지만 미국은 무려 90%에 달한다. 제네릭을 기반으로 성장해온 국내 제약산업에 미국 시장은 확실한 블루오션이 되고 있다는 얘기다.

반면 바이오시밀러의 경우 대부분 FDA보다 EMA 허가가 1~3년가량 더 빨랐다. 셀트리온의 자가면역질환 치료제 '램시마'는 EMA에서 2013년 허가받은 이후 3년 뒤인 2016년 FDA에서 허가를 받았다. 삼성바이오에피스가 2016년 EMA로부터 처음으로 허가받은 바이오시밀러 '에톨로체'(미국명: 에티코보, 유럽명: 베네팔리)와 '레마로체'(미국명: 렌플렉시스, 유럽명: 플릭사비) 2종은 FDA에서 좀 더 늦은 2019년과 2017년에 각각 허가받았다. 항암제인 샴페넷, 자가면역질환 치료제 임랄디 등 바이오시밀러도 마찬가지로 EMA 허가가 먼저 이뤄졌다.
바이오시밀러 제품이 유럽에서 더 빨리 허가를 받은 이유는 2006년 바이오시밀러를 최초로 도입한 이후 허가승인 제도를 꾸준히 업데이트하면서 적극적으로 수용하는 전략을 취했기 때문이다. 반면 미국은 초기에 바이오시밀러 허가 및 사용에 대해 조심스러워하다가 2016년 이후부터 본격적으로 문을 열기 시작했다.
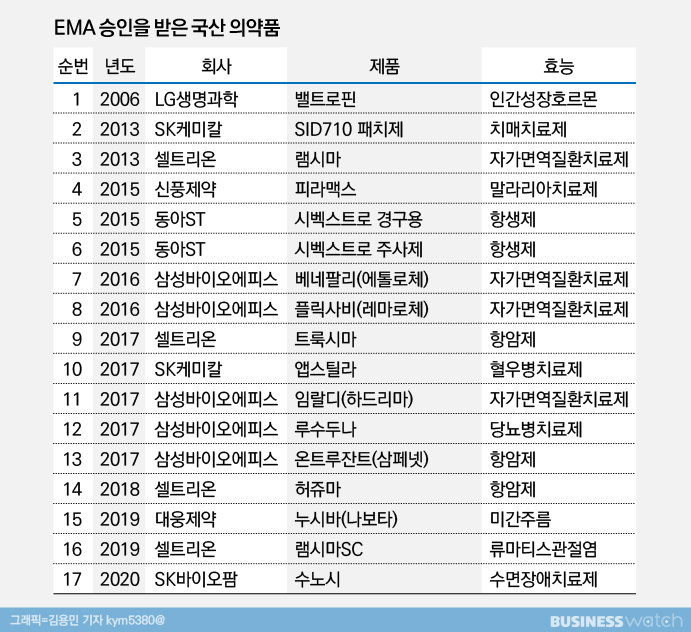
실제로 바이오시밀러 허가 현황을 보면 EMA에서는 2016년과 2017년, FDA에서는 2018년과 2019년에 셀트리온과 삼성바이오에피스의 품목들이 대거 승인을 받았다. 셀트리온이 야심 차게 개발한 피하주사 제형 '램시마SC'도 지난해 EMA에서 먼저 허가가 이뤄졌다.
다만 2003년 최초로 FDA 허가를 획득한 LG생명과학의 인간성장호르몬 '밸트로핀'은 예외였다. 2000년 스위스의 바이오파트너스(BP)와 전략적 제휴를 체결하고, 다국적 임상 개발 및 등록을 추진한 결과 빠르게 FDA의 승인을 받을 수 있었다.
이 밖에 올해 초 코로나19 발발에도 SK바이오팜이 EMA로부터 수면장애치료제 '수노시'를 허가받는 등 글로벌 진출은 계속되고 있다.
업계 관계자는 "글로벌 진출은 매출 확대뿐만 아니라 의약품 선진국 시장에 대한 경험과 기반을 다지기 위한 것"이라며 "앞으로 더 많은 한국 의약품이 해외로 나아가 글로벌 기업으로 성장할 수 있길 기대한다"라고 말했다.

























