국내 보건당국이 글로벌 혁신제품 신속심사 지원체계(GIFT)를 도입한지 1년 8개월에 접어든 가운데 GIFT 대상으로 지정받은 국산 신약 비중은 14%에 불과한 것으로 나타났다.
GIFT는 생명위협질환이나 중대한 질환 치료제 등의 혁신성이 뛰어난 의약품을 신속하게 시장에 출시하고 환자에게 빨리 공급하기 위해 지난 2022년 9월 도입됐다. 대상 품목은 △생명을 위협하는 암 등 중대한 질환 또는 희귀질환 치료를 목적으로 하는 의약품 △생물테러감염병 또는 감염병의 대유행 등 공중보건에 심각한 위해를 끼칠 우려가 있는 감염병의 예방 또는 치료를 목적으로 하는 의약품 △보건복지부가 지정한 혁신형 제약기업이 개발한 신약 △신속심사 대상 의약품과 의료기기 조합 등이다.
GIFT 대상 지정 사유는 △기존 치료법 없음 △유효성 개선 △안전성 개선 △혁신형 제약기업 개발 신약으로 구분된다. GIFT 대상 품목으로 지정되면 평균 120일이 걸리던 품목허가 심사기간이 90일로 줄어든다. 특히 기존 신속심사와 달리 안전에 직접 관련없는 일부 자료는 시판 후 제출, ICH(국제의약품 규제조화위원회) 등 글로벌 심사기준 선제 적용, 임상개발 초기단계부터 우선심사 대상 지정 등의 혜택이 주어진다.
하지만 대부분의 GIFT 지정 신약은 글로벌 제약사가 개발했거나 개발 중인 제품이 상당수를 차지하고 있다.
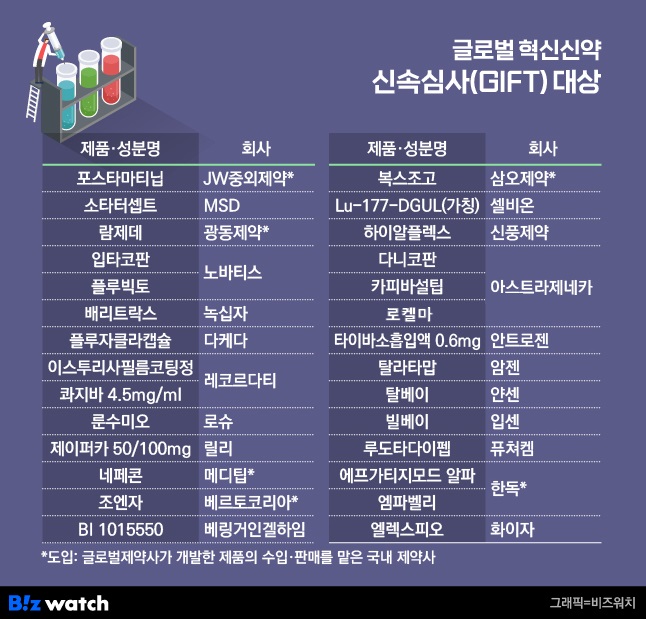
28일 기준 식품의약품안전처로부터 GIFT 지정을 받은 제품은 총 28개로, 이 중 글로벌 제약바이오 회사의 제품은 16개, 국내 제약바이오 기업 제품 12개였다. 하지만 12개 제품 중 8개는 글로벌 제약바이오 기업으로부터 도입해 수입, 판매를 맡은 제품이었고 국내 제약바이오 기업이 자체 개발 중인 신약은 4개에 그쳤다. GIFT에서 차지하는 비중이 14%에 불과하다.
GIFT 대상 품목으로 지정된 국산 혁신 신약 4개는 △셀비온의 전이성 거세 저항성 전립선암 치료제 'Lu-177-DGUL(가칭)' △퓨쳐켐의 거세저항성 전립선암 방사성 리간드 치료제 '루도타다이펩(FC-705)' △신풍제약의 골관절염 치료제 '하이알플렉스' △GC녹십자(질병관리청 공동개발)의 탄저균 백신 '배리트락스' 등이다. 셀비온과 퓨쳐켐은 기존 치료법이 없는 신약, 신풍제약과 녹십자는 혁신형 제약기업 개발 신약으로 GIFT 지정을 받았다.
먼저 셀비온의 Lu-177-DGUL은 전립선 특이 막 항원(PSMA)과의 결합을 통해 전립선암 세포내로 치료 방사선을 전달함으로써 DNA 손상을 유도해 세포 사멸을 일으키는 방사선 표적치료제로, 현재 국내 임상2상을 진행 중이다.
퓨쳐켐의 루도타다이펩은 전립선암에만 특이하게 발현되는 PSMA(전립선 특이 세포막 항원)에 결합하는 펩타이드와 치료용 동위원소 'LU-177'을 결합하는 치료제로, 혈관을 통해 암세포까지 도달한 후 LU-177에서 방출되는 에너지로 암세포를 사멸하는 것이 특징이다. 미국과 우리나라에서 각각 임상2상을 진행하고 있다.
신풍제약의 하이알플렉스는 6개월에 1회 투여하는 골관절염치료제로, 지난해 국내 임상 3상을 마치고 품목허가를 신청한 상태다. GC녹십자가 질병관리청과 공동개발한 탄저균 백신 배리트락스도 지난해 품목허가 신청을 제출했다. 식약처으로부터 품목허가를 받으면 세계 최초로 개발에 성공한 재조합 단백질 탄저백신이 된다.
GIFT 지정 대상 품목에 국산 신약이 적은 이유는 그만큼 GIFT 심사가 까다롭기 때문이다. 한 예로 GIFT의 지원 혜택 중 임상개발 초기부터 우선심사가 가능한 내용이 있지만 임상개발 초기에 혁신 신약 가능성을 입증하기는 매우 어렵고 심사기준 자체도 명확하지 않다. 이에 해외 규제기관의 신약 개발 신속 프로그램 적용 여부 등도 GIFT 대상으로 적극 검토될 필요성이 제기된다.
업계 관계자는 "미국 식품의약국(FDA)이나 유럽 의약품청(EMA)으로부터 혁신의약품, 희귀의약품, 신속심사 의약품으로 지정받아도 GIFT 문턱을 넘기가 어렵다"면서 "GIFT는 글로벌 신약의 신속허가를 위한 제도에 불과한 것 같다. 국산 신약들이 GIFT 혜택을 받을 수 있는 요건들이 좀더 확대될 필요가 있다"고 했다.