품목허가를 받았지만 장기간 제조 및 수입되지 않은 의약품 10개 중 3개가 지난해 정리됐다.
식품의약품안전처는 30일 2024년도 의약품 품목갱신 현황을 공개했다.
의약품 품목 갱신 제도는 이미 허가·신고된 의약품에 대한 주기적, 체계적인 사후관리 및 소비자 공급 품목 중심으로 안전관리를 집중하기 위해 2018년부터 본격 시행된 제도다.
허가·신고받은 의약품에 대해 5년 주기로 안전성·유효성·품질관리 자료 등을 종합적으로 평가, 갱신 여부를 결정한다. 5년의 품목허가 유효기간이 지나면 허가를 갱신해야 지속적으로 생산·수입이 가능하다. 다만 원료의약품과 수출만을 목적으로 한 의약품은 제외된다.
식약처에 따르면 지난해 품목갱신 대상 의약품은 총 9495개 품목으로, 이 중 73%인 6878개 품목의 허가가 갱신됐다.
제도 시행 초기인 2018년부터 2023년 6월까지 총 3만9538개 중 2만3559개(60%) 품목이 갱신된 것과 비교하면 갱신율이 13%포인트(p) 높아졌다. 의약품 갱신제도 시행으로 장기간 제조·수입되지 않는 의약품이 정리되고 실제 유통되는 의약품 중심으로 품목이 재편된 영향으로 분석된다.
갱신 대상 의약품 중 전문의약품(병원 처방) 비중이 84%(7936개), 일반의약품(약국 구입) 비중은 16%(1523개)였다. 전문의약품 갱신율은 제도시행 초기 70%에서 73%로 늘었고 일반의약품은 42%에서 70%로 대폭 증가했다.
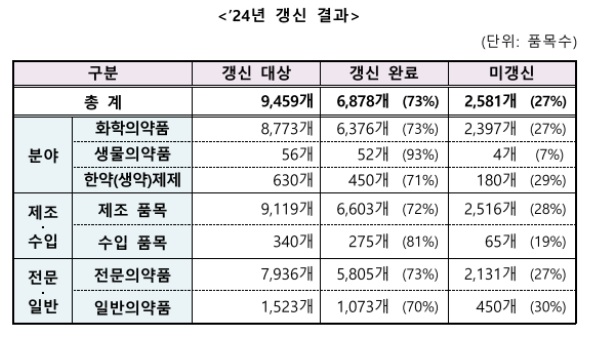
분야별 갱신된 품목은 화학의약품이 6376개(93%)로 대부분을 차지했으며 한약제제와 생물의약품이 각각 450개(6%), 52개(1%)였다.
이와 함께 식약처는 품목갱신 시 허가 사항 중 효능·효과 및 용법·용량을 입증할 수 있는 자료가 확인되지 않는 4개 성분, 54개 품목에 대해 허가사항 변경명령 조치를 내렸다.
각 성분별 주요 조치 내용으로는 △골격근이완제제 '바클로펜' 정제의 소아 투여량을 체중단 용량으로 변경 및 연령별 최대 투여량 설정 △뇌기능 개선제 '니세르골린' 정제의 1일 투여횟수를 1일 3회로 조정 △항혈소판제 '트리플루살' 캡슐제 효능·효과 중 혈전증에 의한 합병증을 포함한 동맥혈전색전질환의 '예방'을 '재발방지(2차예방)'로 변경 △치질약 '디오스민' 캡슐제 사용상 주의사항에 수유부 금기 추가 등이었다.
또 품목갱신 후속조치로 2020년 임상재평가가 진행된 '디히드록시디부틸에테르' 액제 등 3개 품목은 임상재평가 결과에 따라 허가사항 중 용법·용량을 1회(0.5~1.0g) 1일 1~3회에서 1회(0.5g) 1일 3회로 변경하도록 조치했다.
식약처는 "의약품 품목 갱신 제도가 일정수준 정착단계에 이르러 효능·효과, 용법·용량 등 허가사항 변경명령 조치가 줄어들었다"면서 "앞으로도 최신 의약품 안전 정보를 반영해 주기적·체계적으로 의약품을 철저하게 관리할 계획"이라고 말했다.