국내 제약바이오 산업에서 연구개발(R&D) 활동이 본격화한 건 지난 1987년 물질특허가 도입되면서다. 이를 계기로 신약 개발의 중요성이 대두됐고 R&D는 제약바이오 기업들의 핵심 요소이자 미래 비전이 됐다. 글로벌 블록버스터급 신약에 거는 기대는 투자자들에게도 이어졌다. 하지만 핑크빛 미래를 꿈꿨던 투자자들의 피해가 잇따르면서 제약바이오 업종에 대한 신뢰도는 바닥을 치고 있다. 제약바이오 기업의 가치판단을 좌우하는 R&D에 대해 짚어본다. [편집자]
후보물질 발굴에만 5년…AI·빅데이터 활용 추세
일반 산업에서 R&D는 연구(Research)와 개발(Development)의 경계가 불분명한 측면이 있다. 하지만 제약바이오 산업에서 R&D는 연구와 개발 부문이 분명하게 나뉜다.
연구 부문은 의약품으로 개발할 후보물질을 탐색 및 발굴하는 것을 의미하는데 효능과 작용기전 등 개발 목표를 설정하고 개발 대상 물질을 선정하는 데만 약 5년이 걸린다. 기업들이 검토하는 후보물질만 5000~1만개에 달하며 많은 제약바이오 기업들이 이 기간을 단축하기 위해 최근 인공지능(AI)과 빅데이터 기술을 도입 및 활용하는 추세다.
개발은 신약 후보물질을 최종 선정한 후 안전성과 유효성을 입증하는 단계를 말하며 연구 단계의 5000~1만개의 후보물질 중 1~2%에 불과한 50개 정도가 동물시험에 진입한다. 본격적인 개발단계라고 할 수 있는 건 임상 1~3상과 허가 신청까지다.
임상 1상부터 허가 성공 확률 7.9% 불과
임상 1상은 소규모 인원으로 안전성을 검증한다. 20~100명 정도의 소규모 인원을 대상으로 하며 수개월에서 1년 정도가 소요되고 건강한 사람을 대상으로 시험하는 만큼 효과성은 확인하기 어려운 측면이 있어 안전성 검증이 가장 중요하다.
임상 2상은 해당 후보물질의 대상 질환을 앓고 있는 100~200명 정도의 소규모 환자를 대상으로 약의 안전성과 효능을 살펴본다. 임상 2상이 신약 개발에서 가장 중요한 단계로 꼽히는데 목표로 하는 질환에 대한 신약 물질의 안전성과 효능을 확인하는 핵심 과정이자 임상 3상에서 돌입하기 위해 최적의 용법·용량을 결정하는 단계이기 때문이다.
임상 3상은 임상 2상에서 결정한 적정 용법 및 용량과 다양한 부작용 사례 등을 수집하는데 1000~5000명에 달하는 환자를 대상으로 효과와 안전성 검증을 거치게 된다(통상 환자 수가 적은 희귀질환은 예외).
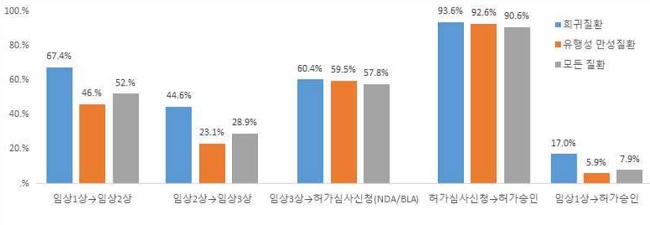
미국바이오협회 보고서에 따르면 지난 2011년부터 2020년까지 임상 단계별 진입에 성공 확률은 임상 1상에서 임상 2상이 52%, 임상 2상에서 3상이 28.9%, 임상 3상을 마치고 허가를 신청할 확률은 57.8%였다. 임상 3상에서 약의 유효성 목표치를 달성하지 못했거나 심각한 부작용 등이 발견될 가능성이 있고 임상 3상까지 도달했더라도 10개 중 4~5개는 허가 문턱에 다다르지 못한다는 얘기다. 보건당국에 품목허가를 신청한 후 최종 허가에 성공하는 건 그 중에서도 90.6%였다. 전체적으로 임상 1상에서 승인까지의 성공률은 7.9%에 불과했다.
임상 단계별 걸리는 기간은 임상 1상 2.3년, 2상 3.6년, 3상 3.3년, 허가승인 단계 1.3년 등이었고 임상 1상부터 허가까지 평균 개발 속도는 10.5년이었다. 바이오 투자에 있어 임상 2상이나 3상 진입이 당장은 긍정적인 이슈일 수 있으나 개발에 오랜 기간이 소요되는 데다 장기적으로는 실패 확률이 높은 만큼 나중에는 악재로 돌아올 가능성도 높다는 의미다.
최초 국산 신약 '아직'…"개발 단계서 성공 가늠 어려워"
신약은 기존에 없던 최초 약물인 '퍼스트 인 클래스(First-in-Class)'와 계열 내 최고 약물을 의미하는 '베스트 인 클래스(Best-in-Class)'로 나뉜다. 국내 제약바이오 기업 가운데 '퍼스트 인 클래스' 개발에 도전하고 있는 곳도 다수 있지만 아직 성공한 사례는 없으며 국산 신약으로 허가받은 약물은 대부분 '베스트 인 클래스'다. '퍼스트 인 클래스'는 개발 난이도가 매우 높은 반면, 개발에 성공할 경우 막대한 부가가치를 창출할 수 있다는 기대감이 높다. 하지만 허가 이후에도 부작용으로 허가가 취소되고 시장에서 퇴출돼 조용히 사라진 '퍼스트 인 클래스' 약물들도 있어 허가 이후에도 리스크는 존재한다.
'베스트 인 클래스'는 기존에 개발된 '퍼스트 인 클래스' 약물과 동일한 작용기전으로 유효성, 안전성 등을 개선한 신약을 말한다. '베스트 인 클래스'는 '퍼스트 인 클래스'보다 개발 실패 위험이 적지만 개발에 성공하더라도 글로벌 블록버스터 약물이 되기 위해서는 '퍼스트 인 클래스'보다 월등한 약효나 부작용 개선 등을 입증해야 한다.
'퍼스트 인 클래스'나 '베스트 인 클래스'가 글로벌 시장에서 성공하면 국내 기업들은 글로벌 기업으로 단숨에 도약할 수 있다. 국내 제약바이오 기업들이 신약 R&D에 사활을 거는 이유다. 하지만 신약을 개발하는 기업들 조차 성공을 확신할 수 없고 일반 투자자들이 신약 R&D의 가치를 판단하기는 더욱 어려울 수밖에 없다.
업계 관계자는 "신약 개발 기업들도 임상 결과가 나와야 다음 임상 단계로 진입할 가치가 있는지 판단할 수 있고 임상 3상이 끝난 후에도 품목허가 승인을 획득할 수 있을 지 알 수 없다"면서 "허가를 획득하더라도 시장에서 인정받지 못하면 실패한 것과 다름 없어 단순히 기업의 역량만으로 신약의 성패를 가늠하기 어려운 분야"라고 말했다.