
국내 바이오기업들이 신약 개발에 필요한 초기 임상을 진행하기 위해 호주로 발길을 돌리고 있다. 국내와 미국의 경우 임상1상 시험계획을 승인받기 위해 제출해야 하는 자료가 방대하고 심사기준도 까다로운 반면 호주는 보건당국이 아닌 연구기관의 간소한 승인절차만 거치면 돼 수월하기 때문이다.
또 국내의 경우 임상1상 시험계획을 제출하고 승인을 받기까지 3~6개월이 걸리지만 호주는 6~8주로 짧은데다 R&D 비용도 환급해주는 제도를 운영하고 있어 글로벌 임상 메카로 떠오르고 있다.
바이오, 임상1상 위해 호주행…호주법인 설립도
바이오솔루션은 지난 18일 호주 인체연구윤리위원회(HREC)에 동종연골세포치료제 '카티로이드'의 임상1/2상 동시 진행을 위한 임상시험계획(IND) 승인을 신청했다. 앞서 바이오솔루션은 지난 2월 식품의약품안전처에 국내 임상1상 시험계획을 신청했다가 지난 6월 반려된 바 있다. 이에 글로벌 임상으로 전략을 선회해 호주에서 먼저 임상에 돌입한 것이다. 이를 위해 지난 7월 호주에 100% 자회사를 설립하기도 했다.
바이오솔루션뿐만 아니라 다수 국내 바이오기업들도 임상1상 진행을 위해 호주행을 택하는 추세다. 나이벡은 국내 임상을 생략하고, 호주에서 염증성 장질환 치료제 후보물질 'NP-201'의 임상 1상을 완료한 뒤, 현재 2상 진입을 준비 중이다. 주목할 점은 이 호주 임상1상 데이터를 바탕으로 NP-201이 지난 5월 미국 제약사에 총 4억3500만 달러(약 5952억원) 규모로 기술이전에 성공했다는 사실이다.
오토텔릭바이오는 지난 5월 호주에서 항암 안티센스 올리고뉴클레오타이드(ASO) 신약 후보물질 'ATB-320'의 임상1상 시험계획을 승인받아 최대내약용량(항암제 용량을 올렸을 때 암세포를 최대로 죽이면서 안전성을 유지하는 용량)을 파악하기 위한 시험을 진행 중이다.
강스템바이오텍도 같은 달 중등도 및 중증 급성 호흡곤란 증후군 환자를 대상으로 인간 제대혈 유래 중간엽 줄기세포의 임상1상을 신청했다. 강스템바이오텍 계열사 프리모리스테라퓨틱스는 지난해 호주에서 엑소좀 기반 화상치료제 'PMS-101'의 임상 1/2a상 시험계획을 승인받아 개발을 진행하고 있다.
큐리언트는 지난해 호주에서 40명을 대상으로 부룰리궤양 치료제 '텔라세벡'의 임상1상 진행했다가 지난 7월 임상 대상자를 80명으로 확대, 추가 임상에 착수했다. 부룰리궤양은 마이코박테리움 울란스라는 균에 의해 발생하는 열대성 소외질병(NTD) 중 하나로, 주로 사하라 이남 아프리카와 호주 등 특정 지역에 국한돼 발생하는 감염성 피부 질환이다.
인벤티지랩은 호주에서 장기지속형 알츠하이머병 치료제 'IVL3003'의 임상 1·2상을, 약물중독 치료제 'IVL3004'의 임상1상을 진행하고 있으며 올릭스도 지난 5월 탈모치료제 'OLX104C'의 임상1/2상 시험계획을 승인받고 개발에 본격 돌입했다. 이밖에 파로스아이바이오는 2019년 호주에 현지법인을 두고 자사 파이프라인의 초기 연구 및 임상에 집중하고 있다.
간소한 임상승인 절차·R&D비용 환급 등에 호주 선호
국내 바이오기업들이 호주에서 초기 임상을 선호하는 이유는 간소한 절차, 빠른 승인 속도, 그리고 R&D 비용 환급 제도 등 매력적인 환경을 갖추고 있기 때문이다.
호주는 인체연구윤리위원회(HREC)의 승인만으로 임상시험이 가능한 CTN(Clinical Trial Notification) 제도를 운영하고 있다. HREC는 대학병원 같은 국립·주립 병원 시스템에 속한 공공기관과 민간 기업이 운영하는 병원, 전문 임상시험기관(CRO), 클리닉 등 사설기관으로 나뉜다.
HREC의 허가만 떨어지면 보건당국의 별도 승인 없이 초기 임상 개시가 가능하다. 이는 복잡한 규제와 긴 심사 기간에 부딪힌 한국 바이오기업들에게 실질적인 대안으로 작용하고 있다.
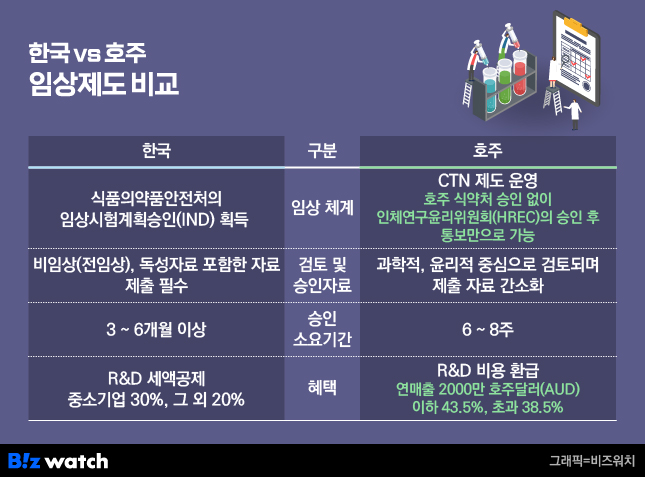
심사속도도 빠르다. 우리나라는 식약처 심사에 평균 3~6개월이 걸리지만 호주 HREC의 경우 공공기관은 약 6~8주, 사설기관은 2~4주면 임상 진입이 가능하다. 국내의 경우 R&D 세액공제 혜택을 20~30% 주고 있지만 수익이 없는 바이오기업들은 세제 혜택을 받기 어렵다. 반면 호주는 R&D에 투입된 비용의 최대 43.5%를 현금으로 환급해주는 제도를 운영하고 있다. 수익을 내지 못하는 바이오 벤처 기업들에게는 실질적인 혜택이 되는 셈이다.
호주 임상 시스템에도 한계는 존재한다. 일부 고위험 생물학적 제제나 2·3상으로 확대하기 위해서는 호주 식약처(CTA) 승인을 받아야 하고 미국 식품의약국(FDA)이나 유럽의약품청(EMA) 기준에 맞춘 비임상 자료 제출 등이 필요할 수 있다.
대상자 모집 측면에서도 한계가 있다. 호주는 건강한 성인을 대상으로 한 초기 안전성 시험에는 매우 적합하지만, 암 환자나 중증 질환자 등 고위험군의 임상시험은 환자 모집이 쉽지 않고, 경우에 따라 호주 식약처의 규제가 국내보다 까다롭게 적용될 수 있다. 호주의 R&D 비용 환급 제도 역시 환급 받은 자금은 호주 내에서만 사용해야 한다는 제약이 따른다.
호주 임상1상 진입장벽이 낮아 공신력이 부족하다는 문제도 있다. 국내 코스닥 상장 심사나 투자 평가에서 호주 임상 데이터가 상대적으로 낮은 평가를 받는 경향이 있는 만큼 기업 입장에선 신중한 검토가 필요한 부분이다. 이에 국내와 호주 임상을 병행하거나, 미국 임상을 함께 준비해야 기술력이나 신뢰도를 인정받을 수 있는 구조라는 지적도 나온다.
그럼에도 불구하고 호주는 국내 임상 진입의 벽을 넘지 못한 기업들에게 유연한 첫 관문이 되어주고 있으며, 빠른 초기 데이터 확보를 통해 글로벌 파트너링과 기술이전 기회를 선점할 수 있다는 점에서 강력한 임상 거점으로 자리매김하고 있다.
바이오 업계 관계자는 "현재 식약처의 임상시험 승인 절차는 과도한 비임상 자료 제출 요구, 심사 기간의 장기화, 불명확한 판단 기준 등으로 인해 혁신신약의 조기 개발을 저해하는 요인"이라면서 "한국이 신약 개발 강국으로 도약하기 위해서는 호주처럼 현실적인 임상 승인 제도 개선과 R&D 인프라 강화, 인센티브 제도가 반드시 병행돼야 한다"고 말했다.



























