
◇ 동아에스티, 2015년에만 3연속 신약..국내 최다 보유
동아쏘시오홀딩스는 식품의약품안전처에 등록된 국산 신약 29개중 4개를 배출해 국내 #[제약}그룹 가운데 가장 많은 신약 개발 실적을 보유하고 있다. 2005년 동아제약의 발기부전치료제 자이데나정이 국산 신약 10호에 이름을 올리며 신약개발 신호탄을 쐈다.
동아제약은 2013년 동아에스티를 그룹의 전문의약품 연구개발(R&D) 중심 계열사로 분리했다. 동아에스티가 신약 개발을 담당하고, 이를 동아제약이 국내 판매하고 지주사인 동아쏘시오홀딩스가 해외 판매를 이끄는 방식으로 역할을 분담하고 있다.
동아에스티는 2015년 한해에만 4월 향균제 '시벡스트로정'과 '시벡스트로주', 10월 경구용 혈당강하제 '슈가논정' 등 3개품목(24~26호)에 대해 식약처 허가를 따냈다. 국내 단일제약사 신약 보유수 1위다. 최근 3년동안 국내에서 식약처 허가가 난 신약은 9개품목인데 이중 3개가 동아에스티 작품이다.
동아에스티 다음으로는 종근당과 JW중외제약, 동화약품, SK케미칼, LG생명과학, 일양약품 등 6개사가 각각 2개씩 국산 신약 허가실적을 보유하고 있다. 이밖에 동아제약을 포함해 보령제약과 한미약품 등 13개사가 각각 1개씩 배출한 상태다.
◇ 개발 초기부터 다국적제약사 눈독..해외서 순항
동아에스티 다음으로는 종근당과 JW중외제약, 동화약품, SK케미칼, LG생명과학, 일양약품 등 6개사가 각각 2개씩 국산 신약 허가실적을 보유하고 있다. 이밖에 동아제약을 포함해 보령제약과 한미약품 등 13개사가 각각 1개씩 배출한 상태다.
◇ 개발 초기부터 다국적제약사 눈독..해외서 순항
동아에스티가 최근 배출한 국산 신약들은 모두 해외에서도 순항중이다. 회사가 개발하는 파이프라인 상당수가 개발 초기단계부터 다국적제약사들의 관심을 받으면서 국내와 해외에서 투트랙으로 진행되는 프로젝트가 많다.

동아에스티의 첫 신약인 향균제 '시벡스트로'는 전임상단계에서부터 다국적제약사들에 기술수출돼 특히 주목받았다. 다국적제약사 머크사는 북미·유럽, 바이엘사는 아시아 등 기타지역에서 시벡스트로를 판매할 수 있는 권리를 확보한 뒤 자체 개발·판매중이다.
머크사는 시벡스트로에 대한 피부감염 적응증으로 2014년 미국 FDA와 2015년 유럽 EMA에서 신약 허가를 따내 판매중이며, 폐렴 적응증 추가를 위해 임상3상(MK-1986)을 진행중이다. 바이엘사는 피부감염증으로 지난해 10월 일본에서 임상3상을 마쳤으며, 올해 1월 같은 증상으로 글로벌임상에 착수해 오는 2019년 2월 완료를 예상하고 있다.
국내에선 동아에스티가 피부감염증으로 2015년 신약 허가를 따낸 뒤 향후 전략을 놓고 저울질중이다. 폐렴 등 적응증 추가 확보를 위해 시벡스트로를 개발한 DA-7218 프로젝트를 이어가거나 앞서 개발에 착수한 머크사로부터 완제품을 역수입할지를 놓고서다. 현재로선 완제품 수입 가능성이 더 높게 점쳐진다.
머크사는 시벡스트로에 대한 피부감염 적응증으로 2014년 미국 FDA와 2015년 유럽 EMA에서 신약 허가를 따내 판매중이며, 폐렴 적응증 추가를 위해 임상3상(MK-1986)을 진행중이다. 바이엘사는 피부감염증으로 지난해 10월 일본에서 임상3상을 마쳤으며, 올해 1월 같은 증상으로 글로벌임상에 착수해 오는 2019년 2월 완료를 예상하고 있다.
국내에선 동아에스티가 피부감염증으로 2015년 신약 허가를 따낸 뒤 향후 전략을 놓고 저울질중이다. 폐렴 등 적응증 추가 확보를 위해 시벡스트로를 개발한 DA-7218 프로젝트를 이어가거나 앞서 개발에 착수한 머크사로부터 완제품을 역수입할지를 놓고서다. 현재로선 완제품 수입 가능성이 더 높게 점쳐진다.

| ▲ 동아쏘시오홀딩스 R&D센터.사진 제공=동아쏘시오홀딩스 |
동아에스티가 신약 허가를 따낸 슈가논은 임상단계에서 해외 제약사들에 기술수출됐다. 국내에선 2016년 당뇨병치료약 '슈가논정'과 '슈가메트서방정'으로 출시돼 각각 현재까지 누적으로 43억원과 37억원의 매출을 기록했다. 경쟁 제품 대비 혈당강하 효과가 우수하고 신장장애 환자의 경우에도 용량 조절이 필요없다는 장점이 반영됐다.
슈가논 기술수출은 2014년 브라질 유로파마사와 처음 체결됐다. 유로파마사는 2014년 브라질에 이어 2015년 남미 18개국에 대한 판권을 사간 뒤 브라질 현지에서 당뇨병치료제로 임상2상을 진행중이고, 남미 17개국에선 개발·허가를 밟고 있다. 이듬해에는 러시아 게로팜사가 러시아 등 인근 독립국가연합(CIS) 3개국에 대해 판권을 사간 뒤 러시아 현지에서 임상3상을 진행중이다.
또 미국과 유럽, 호주에 대한 슈가논 판권을 사간 미국 토비라사는 2016년 11월 1조9000억원에 미국 다국적기업 앨러간사에 인수됐다. 앨러간사는 슈가논 기술을 비알콜성 지방간염(NASH) 치료제 개발 목적으로 3개 프로젝트를 묶은 NASH 프로그램을 진행중이다. 현재까지 비알콜성 지방간염(NASH) 치료제로 개발된 약물이 없는데다 2025년에 NASH치료제 시장이 36조원에 달할 것으로 예상돼 기대를 받고 있다.
◇ '성실한 실패' 용인되는 조직문화+R&D 투자 확대
동아에스티가 신약 개발에서 앞서 나가는 데는 1990년대 초반 "신약개발이 곧 사회공헌"이라는 슬로건을 세운 동아쏘시오홀딩스의 조직문화와 관련이 깊다.
동아제약을 중심으로 확대된 이 조직문화는 2013년 동아제약에서 분리돼 나온 동아에스티에 그대로 옮겨졌다. 동아에스티 R&D 인력 250명 가운데 30% 이상이 동아제약 등에서 10년 이상 신약개발 경험을 갖고 있다. 일찍이 갖춰진 신약개발에 초점을 둔 그룹 분위기와 인프라가 2015년 동아에스티에서 결실을 맺은 것이다.

| ▲ 사진 제공=동아쏘시오홀딩스 |
동아에스티는 설립이래 현재까지 전체 매출의 10% 이상의 자금을 R&D에 쏟고 있다. 신약개발을 사회공헌 차원에서 독려하는 그룹 문화는 동아에스티에서 '성실한 실패'를 인정하는 문화를 낳았다. 신약개발은 1% 미만의 낮은 성공률때문에 실패를 용인하지 않는 조직에서는 도전 자체가 어렵다. 동아에스티는 '성실한 실패'를 인정하는데 나아가 보상체계도 갖췄다.
동아에스티 직원의 1인 평균 급여는 지난해 기준 약 6200만원으로 업계 상위 5위권에 든다. 이에 따라 평균 근속연수도 9년8개월로 유한양행과 삼진제약에 이어 세번째로 길다.
회사 관계자는 "최선을 다한 경우라면 실패하더라도 허용해주는 분위기가 있어 연구개발부서에서 과감하게 새로운 개발에 도전할 수 있다"며 "실패 자체를 꾸짖는 대신 성공할때 높은 인센티브 등으로 후하게 포상한다. 지난해 12월 다국적제약사 애브비와 맺은 면역항암제 기술수출 계약이 대표적"이라고 전했다.
회사 관계자는 "최선을 다한 경우라면 실패하더라도 허용해주는 분위기가 있어 연구개발부서에서 과감하게 새로운 개발에 도전할 수 있다"며 "실패 자체를 꾸짖는 대신 성공할때 높은 인센티브 등으로 후하게 포상한다. 지난해 12월 다국적제약사 애브비와 맺은 면역항암제 기술수출 계약이 대표적"이라고 전했다.
◇ 면역항암제 MerTK '다크호스'..희귀질환 분야도 공들여
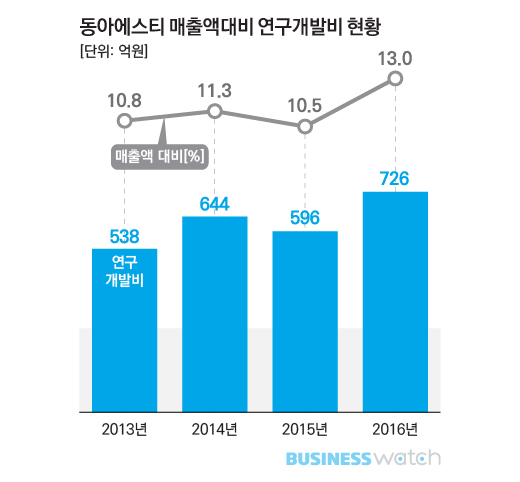
동아에스티는 최근 R&D 투자를 더 늘리고 있다. 지난해 동아에스티 R&D비용은 1년전 596억원과 비교해 21.8% 늘어난 726억원을 기록했다. 회사 매출대비 13% 수준이다. 올해 들어서는 상반기까지에만 420억원을 R&D에 투자해 매출액대비 연구개발비가 15.8%까지 치솟았다.
동아에스티는 최근 R&D 투자를 더 늘리고 있다. 지난해 동아에스티 R&D비용은 1년전 596억원과 비교해 21.8% 늘어난 726억원을 기록했다. 회사 매출대비 13% 수준이다. 올해 들어서는 상반기까지에만 420억원을 R&D에 투자해 매출액대비 연구개발비가 15.8%까지 치솟았다.
최근 주력하고 있는 프로젝트는 항암제와 희귀질환 분야다.
면역항암제는 신체의 면역시스템을 활성화해 스스로 암을 치유할 수 있도록 하는 기술이다. 암세포에 대한 면역억제 반응을 유발하는 단백질인 MerTK를 활용한다. 기존 면역항암제나 다른 계열의 항암제와 함께 투여되면 항암효과를 크게 높일 것으로 기대된다.
이렇게 기대를 받던 DA-4501 프로젝트는 후보물질 도출 이전 단계이던 지난해 12월 다국적제약사 애브비에 기술수출됐다. 계약금 4000만달러를 받았고 향후 개발 및 허가, 판매가 예정대로 진행되면 마일스톤까지 합치면 총 5억2500만달러다. 동아쏘시오그룹 창사이래 가장 크게 진행된 계약이다. 양사는 전임상(동물실험)까지 공동개발하고 이후 애비브는 한국을 제외한 세계시장에서 임상과 허가, 판매 등을 담당한다.
이렇게 기대를 받던 DA-4501 프로젝트는 후보물질 도출 이전 단계이던 지난해 12월 다국적제약사 애브비에 기술수출됐다. 계약금 4000만달러를 받았고 향후 개발 및 허가, 판매가 예정대로 진행되면 마일스톤까지 합치면 총 5억2500만달러다. 동아쏘시오그룹 창사이래 가장 크게 진행된 계약이다. 양사는 전임상(동물실험)까지 공동개발하고 이후 애비브는 한국을 제외한 세계시장에서 임상과 허가, 판매 등을 담당한다.
주목할만한 또 다른 파이프라인은 아라네스프의 바이오시밀러를 개발하는 DA-3880이다. 2세대 EPO(Erythropoietin) 지속형 적혈구조혈자극제 아라네스프는 만성신부전증 환자의 빈혈이나 일부 암 환자의 빈혈 치료에 쓰인다.
동아에스티는 유럽에서 임상1상을 마치고 현재 임상3상을 준비중이다. 임상1상에서는 아라네스프와 매우 높은 유사성을 입증받았다. 아울러 2014년 1월 일본 산와 카가쿠 켄큐쇼사(산와화학연구소, SKK)와 DA-3880에 대한 기술수출 및 완제품 공급계약을 체결했다. SKK는 일본에서 임상1상을 완료하고 임상3상을 진행중이다.
이밖에 과민성 방광치료제인 DA-8010가 유럽에서 임상1상을 진행중이며, 차세대 기전의 당뇨병치료제 DA-1241가 국내 전임상을 완료하고 미국 임상1상을 이어가고 있다.
이밖에 과민성 방광치료제인 DA-8010가 유럽에서 임상1상을 진행중이며, 차세대 기전의 당뇨병치료제 DA-1241가 국내 전임상을 완료하고 미국 임상1상을 이어가고 있다.
























총 1개의 댓글이 있습니다.( 댓글 보기 )